جدول محتوا
پروتئومیکس
- دسته بندی: مطالعات امیکس
- نویسنده: مدیر ایده زیست
جدول محتوا
پروتئومیکس به مطالعه همزمان کل پروتئوم گفته می شود. پروتئوم مجموعهای از پروتئین ها است که در یک ارگانیسم، سیستم یا بافت بیولوژیکی تولید میشود. پروتئوم ثابت نیست، بلکه از سلولی به سلول دیگر متفاوت است و در طول زمان تغییر میکند. اگرچه بیان پروتئین را میتوان با مطالعه بیان mRNA، که حدواسط میانی بین ژنها و پروتئینها است، استنباط کرد اما میزان بیان mRNA الزاما به صورت مستقیم با سطح تولید پروتئین ارتباط ندارد. علاوه بر این، مطالعه mRNA تغییرات، برش، تشکیل کمپلکسهای پیچیده و استقرار آنها و یا رونوشتهای متنوع mRNA را در نظر نمیگیرد.
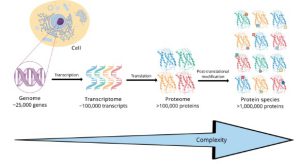
شکل 1ـ افزایش پیچیدگی از ژنوم به پروتئوم. ژنوم در همه سلول های یک جاندار یکسان بوده و در طول عمر یک موجود زنده تقریباً ثابت میماند. در مقابل، از هر ژن ممکن است چندین نوع پروتئین تولید شود. نوع این پروتیئن ها در بین سلول های مختلف یک جاندار و نیز در طول عمر یک سلول به طور قابل توجهی تغییر میکنند.
اهدافی که با پروتئومیکس دنبال میشود:
- – کی و کجا پروتئینها بیان میشوند
- – تعیین میزان تولید، تخریب و فراوانی حالت پایدار پروتئینها
- – درگیری پروتئینها در مسیرهای متابولیک
- – حرکت پروتئینها بین بخشهای زیر سلولی
- – نحوه اصلاح پروتئینها (به عنوان مثال ، تغییرات پس از ترجمه مانند فسفوریلاسیون)
- – نحوه تعامل پروتئینها با یکدیگر
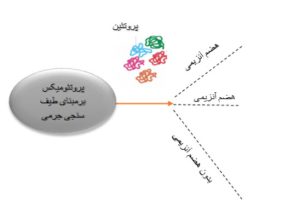
دامنه مطالعات پروتئومیکس:
1-پروتئومیکس ساختاری: پروتئومیکس ساختاری تعیین ساختار پروتئینی سه بعدی (3D) با وضوح اتمی در مقیاس ژنوم به منظور درک بهتر رابطه بین توالی، ساختار و عملکرد پروتئین است. داکینگ مولکولی، کریستالوگرافی اشعه ایکس و طیفسنجی جرمی از روشهای عمده در مطالعات پروتئومیکس ساختاری میباشند.
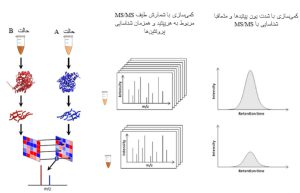
2- پروتئومیکس بیانی: پروتئومیکس بیانی شامل تجزیه و تحلیل بیان پروتئین در مقیاس وسیع است. این مطالعات به شناسایی پروتئینهای اصلی در یک نمونه خاص، و همچنین شناسایی پروتئینهایی که به طور متفاوت در نمونههای مرتبط – مانند بافت بیمار و بافت سالم – بیان میشوند کمک میکنند. اگر پروتئینی فقط در یک نمونه بیمار یافت شود، میتواند یک هدف دارویی مفید یا نشانگر تشخیصی باشد. روشهای طیفسنجی جرمی مبتنی بر ژل و غیر مبتنی بر ژل به طور عمده برای مطالعه پروتئومیکس بیانی استفاده میشوند. در شمای زیر کلیات پروتئومیکس بیانی آورده شده است.
3-پروتئومیکس عملکردی: پروتئومیکس عملکردی حوزه تحقیقاتی نو ظهوری در زمینه پروتئومیکس است که بر دو هدف اصلی یعنی روشن شدن عملکرد بیولوژیکی پروتئینهای ناشناخته و تعریف مکانیسمهای سلولی در سطح مولکولی متمرکز شده است. از مهمترین روشهای مطالعه پروتئومیکس عملکردی میتوان به الایزا اشاره کرد.
4- توالی آمینواسیدی: این مطالعات به شناسایی پروتئینها و بدست آوردن توالی آمینواسیدی آنها کمک میکند. روش اِدمن و در سطح بالاتر نیز استفاده از طیفسنجی جرمی، دو تکنیک مهم در حوزه توالی یابی اسیدهای آمینه می باشند.
انواع روشهای مطالعه پروتئومیکس:
الف- روشهای مبتنی بر ژل
رایجترین روش جداسازی و تعیین کمی پروتئینها، پروتئومیکس مبتنی بر ژل است. این تکنیک، یک روش کامل برای غربالگری بیان پروتئین در مقیاس بالا و یک روش ارزانتر در مقایسه با روشهای غیر مبتنی بر ژل است. روشهای مبتنی بر ژل به همراه طیفسنجی جرمی در مطالعه پروتئومیکس بیانی بسیار کاربرد دارند. روشهای مبتنی بر ژل را میتوان به سه گروه اصلی تقسیم کرد:
ژل الکتروفورز یک بعدی (1D-GEL)
در این روش، ابتدا پروتئینها بر مبنای وزن مولکولی روی ژل جدا شده و سپس شناسایی آنها با روش طیفسنجی جرمی صورت میگیرد.
مزیت: امکان شناسایی پروتئینها بعد از انجام روشهای خالصسازی فراهم میشود.
عیب: برای محیطهای پیچیده، ژل یک بعدی به دلیل همپوشانی باندهای پروتئینی کاربرد ندارد.
ژل الکتروفورز دو بعدی (2D-GEL)
در این روش، جداسازی پروتئینها براساس بار و وزن مولکولی بوده و سپس شناسایی آنها با روش طیفسنجی جرمی صورت میگیرد. این روش قادر به نمایش کمی پروتئین بیان شده میباشد.
مزیت: امکان شناسایی و کمیسازی نسبی پروتئینها در محیطهای پیچیده بلافاصله بعد از استخراج آنها فراهم میشود.
عیب: در این روش، جداسازی پروتئینهای اسیدی، بازی، آبگریز و پروتیئن های با بیان کم، دشوار است.
ب– روشهای مبتنی بر آنتیبادی با توان بالا:
روشهای پروتئومیکس مبتنی بر آنتیبادی نقش مهمی در ثبت پروفایل بیان پروتئینهای مرکب و چندتایی را در نمونه سالم و بیمار ایفا میکنند. این روشها، شرایطی (مینیاتوریزه شده) را فراهم میکنند که قادر به ثبت پروفایل همزمان پروتئینهای مرکب به صورت اختصاصی، حساس و سریع هستند. همچنین این روشها، پروتئینهایی با فراوانی کم، حتی پروتئومهای خام نظیر محیطهای بسیار پیچیدهای مشابه سرم را مورد هدف قرار میدهند. تکنیکهای مبتنی بر آنتیبادی به همراه طیفسنجی و یا بدون آن انجام میشود. از مهمترین این تکنیکها میتوان به میکرو آرایه آنتیبادی و الایزا اشاره کرد.
میکرو آرایه آنتیبادی:
میکروآرایه آنتیبادی (که تحت عنوان آرایه آنتیبادی نیز شناخته میشود) شکل خاصی از میکرو آرایه پروتئینی است. در این فناوری، مجموعهای از آنتیبادیهای خالص شده، روی سطح جامد مانند شیشه، پلاستیک، غشاء یا تراشه سیلیکون ثابت میشوند و برهمکنش بین آنتیبادی و آنتیژن هدف آن تشخیص داده میشود. میکروآرایههای آنتیبادی اغلب برای تشخیص بیان پروتئین از مایعات بیولوژیک مختلفی مانند سرم، پلاسما و یا سوپ سلولی و بافت متلاشی شده استفاده میشوند. آرایههای آنتیبادی ممکن است برای تحقیقات اساسی و کاربردهای پزشکی و تشخیصی مورد استفاده قرار گیرد.
الایزا:
این روش در حالت معمول برای ردیابی آنتیژن یا آنتیبادی استفاده میشود. به این ترتیب که یکی از این دو ماده (آنتیبادی یا آنتیژن) در بستر جامد ثابت میشود و برای ردیابی دیگری به کار گرفته میشود؛ اما اساساً برای ردیابی هر جفت مادهای که مثل جفت آنتیژن و آنتیبادی به هم گرایش داشته و قدرت اتصال مناسبی نسبت به هم دارند (مانند اتصال لکتین به گلیکوپروتئینها) میتواند مورد استفاده قرار گیرد.
ج– روشهای مبتنی بر طیفسنجی جرمی
پروتئومیکس مبتنی بر طیفسنجی جرمی به عنوان ابزاری مؤثر برای شناسایی، تعیین خصوصیات و سنجش مقدار پروتئینها که اجزای جدایی ناپذیر فرآیندهای ضروری برای حیات هستند، استفاده می شود. مشخص کردن پروتئینها در سطوح پروتئوم و زیر پروتئوم (به عنوان مثال فسفوپروتئوم، پروتئوگلیکوم) پایهای برای درک جنبههای اساسی زیستشناسی فراهم میکند. فناوریهای نوظهور مانند جداسازی تحرک یونی همراه با اندازهگیریهای پروتئوم مبتنی بر طیفسنجی جرمی و تکنیکهای جداسازی کروماتوگرافی، مانند کروماتوگرافی فاز مایع به طور گسترده برای مطالعات طیفسنجی جرمی به صورت هدفمند و یا غیرهدفمند به کار گرفته شدهاند.
پروتئومیکس هدفمند: مطالعه کمی و کیفی پروتئینهای موجود در یک یا چند نمونه بدون هدف قرار دادن پروتئین خاصی است.
پروتئومیکس غیرهدفمند: در این نوع آنالیز اطلاعات کامل در مورد پروتئین مورد آنالیز مانند جرم مولکولی، زمان بازداری در کروماتوگرافی در دسترس است.
به طور کلی از سه روش عمده در مطالعه پروتئینها بر اساس طیفسنجی جرمی استفاده میشود:
1- پروتئومیکس پایین به بالا: این روش بر مبنای هضم آنزیمی پروتئینها و ایجاد پپتیدهایی با قطعات 30-8 اسید آمینه میباشد. پرکاربردترین آنزیم در این روش تریپسین است که به طور انتخابی پیوندهای پپتیدی را در انتهای کربوکسیلی اسیدآمینههای لایزین و آرژنین هیدرولیز می کند. این تکنیک در روشهای مبتنی بر طیفسنجی جرمی بسیار کاربرد دارد.
2- پروتئومیکس میانه به پایین: این روش بر مبنای هضم جزئی آنزیمی پروتئینها و ایجاد پپتیدهایی با قطعات بیشتر از 30 اسید آمینه میباشد. از این تکنیک بیشتر برای مطالعات اصلاحات پسا ترجمهای و نیز مطالعه هیدرولیز زنجیره آمیدی (deamidation) در آنتیبادیهای مونوکلونال استفاده میشود.
3- پروتئومیکس بالا به پایین: این روش بر مبنای شناسایی پروتئینها بدون هضم آنزیمی بوده و برای پروتئینهایی با وزن کمتر از 50 کیلو دالتون مناسب است.
شکل 3: کلیت روشهای طیفسنجی جرمی پایین به بالا، میانه به پایین و بالا به پایین
مفاهیم مطالعاتی پروتئومیکس بر مبنای طیفسنجی جرمی
1- مطالعات ساختاری:
تعیین ساختار سهبعدی پروتئینها به منظور درک بهتر رابطه بین توالی، ساختار و عملکرد آنها صورت می پذیرد. مهمترین مطالعات ساختاری پروتئینها با روش طیفسنجی جرمی شامل تبادیل هیدروژن ـ دوتریم و طیفسنجی تحرک یونی و طیفسنجی جرمی در حالت نیتیو میباشد.
تبادل هیدوژن-دوتریم:
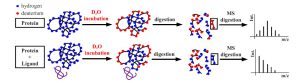
مطالعه تبادل هیدروژن/دوتریوم آمیدی پروتئینها با روش طیفسنجی جرمی به عنوان روشی قدرتمند برای بررسی پویایی تطبیقی پروتئینها و برهمکنش آنها میباشد. در این روش از برچسبگذاری (tag) ایزوتوپ برای بررسی میزان تبادل هیدروژن آمیدی موجود در ساختار پروتئین استفاده میشود. سرعت تبادل، منعکس کننده قدرت پیوند هیدروژنی و دسترسی به حلال در ساختار پروتئین است. تغییر جرم ناشی از حضور دوتریوم در ساختار پروتئین با استفاده از تکنیک طیفسنجی جرمی بررسی میشود. این تکنیک برای پیدا کردن نقاط برهمکنش کننده در تعامل پروتئینها با یکدیگر و یا با لیگاندی مشخص کاربرد دارد.
شکل 4: نمایش تبادل هیدروژن/دوتریوم. پروتئین به صورت آزاد یا در اتصال با لیگاند مورد نظر در بافر با H₂O تحت pH فیزیولوژیکی و دمای اتاق قرار داده میشود. تبادل هیدروژن/دوتریوم با رقیق شدن پروتئین با همان بافر با D₂O آغاز میشود. هیدروژنهای مدفون در داخل ساختار پروتئین یا محافظت شده توسط لیگاند کندتر از هیدروژنهای روی سطح پروتئین مبادله میشوند. تفاوت در جذب دوتریوم در پروتئینهای هضم شده با آنزیم توسط طیفسنجی جرمی تشخیص داده میشود.
طیفسنجی جرمی نیتیو (native-MS):
طیفسنجی جرمی نیتیو به عنوان فرآیندی تعریف میشود که طی آن مولکولهای زیستی بزرگ و پیچیده میتوانند با یونیزاسیون الکترواسپری از یک فاز مایع متراکم به فاز گازی با حفظ ساختار سه بعدی منتقل شوند. این روش برای مشاهده و تجزیه و تحلیل کمپلکسهای بیومولکولی غیر کووالانسی مناسب است. بنابراین، طیفسنجی جرمی نیتیو می تواند برای توصیف کمپلکسهای پروتئینی ـ دارویی و توسعه موثرتر ترکیبات دارویی استفاده شود.
طیفسنجی جرمی تحرک یونی (IM-MS):
طیفسنجی جرمی تحرک یونی، یک تکنیک تحلیلی است که برای جداسازی و شناسایی مولکولهای یونیزه در فاز گازی و بر اساس تحرک آنها در یک گاز بافر حامل استفاده میشود. در این روش مخلوط کمپلکسهای پیچیده که طیفسنجی جرمی به تنهایی قادر به جداسازی آنها نیست، از یکدیگر تشحیص داده میشوند. این روش قادر است در مورد ساختار پروتئینها و تا شدگی آنها اطلاعات قابل قبولی بدست آورد.
طیفسنجی جرمی تحرک یونی. تحرک یون روشی است که زمان حرکت یونها را در یک محفظه پر از گاز، که در آن میدان الکتریکی ضعیفی اعمال میشود، اندازهگیری میکند. بعد از ورود یونها به لوله رانش، یونها دو نیروی متضاد از طریق کشش الکترواستاتیک از طریق سلول و برخورد با گاز بافر را تجربه میکنند که حرکت آنها را به تاخیر میاندازد. یونهایی با سطح بزرگتر برخورد بیشتری با گاز بافر را تجربه میکنند و در نتیجه، در مقایسه با یونهای کوچکتر و فشردهتر با جرم مولکولی و بار مشابه، بیشتر طول میکشد تا از لوله رانش عبور کنند. سپس این یونهای تمایز داده شده وارد طیفسنجی جرمی شده و جرم آنها براساس M/Z اندازهگیری میشود.
مطالعات عملکردی
استفاده از طیفسنجی جرمی در پروتئومیکس عملکردی در مطالعه تعامل پروتئینها بسیار حائز اهمیت است. از مهمترین مطالعات در این زمینه میتوان به بررسی برهمکنش میزبان ـ پاتوژن اشاره کرد. در این مطالعات، کمپلسهای پروتئینی با استفاده از روشهای تمایلی جدا شده و سپس پروتئینهای درگیر در برهمکنش شناسایی میشوند. سپس با استفاده از ابزارها و پایگاه دادههایی نظیر Pathway studio، KEGG و String، مسیرهای بیولوژیکی مطالعه میشوند.
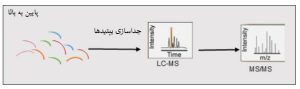
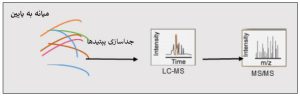
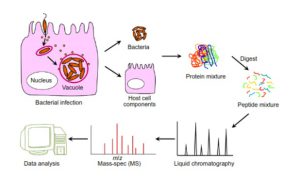
نمونهای از مطالعات پروتئومیکس عملکردی بر پایه تعاملات پروتئینهای میزبان و پاتوژن. پس از عفونت سلولهای میزبان (به عنوان مثال با باکتریهای داخل سلولی)، پاتوژنهای باکتریایی به طور فیزیکی از سلولهای میزبان جدا میشوند و با روشهای مبتنی بر LC-MS تحت آنالیزهای پروتئومیکس قرار میگیرند. اجزای سلولی میزبان را نیز میتوان آنالیز کرد، اگرچه برای پوشش کافی پروتئوم روشهای پیش تغلیظ و پیش جداسازی (به عنوان مثال، غنیسازی درون سلولی و جداسازی ژل پروتئینها بر روی ژل) ضروری است. نمونههای پروتئینی بعد از هضم آنزیمی تحت آنالیزهای کمی و کیفی قرار میگیرند.
مطالعات بیانی
مطالعات بیانی پروتئینها به صورت مبتنی بر ژل و یا غبر مبتنی بر ژل را با طیفسنجی جرمی میتوان انجام داد. این مطالعات میتواند به صورت کیفی و یا کمی صورت بگیرد:
مطالعات کیفی
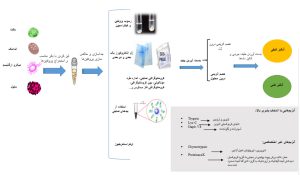
در این نوع مطالعات هدف، شناسایی پروتئینها بدون اندازه گیری مقدار و یا بررسی تغییرات کمی آنها میباشد. در این مطالعات بعد از هضم آنزیمی پروتئین مورد نظر، دو روش برای شناسایی آن میتوان به کار برد: روش اول که بیشتر برای تأیید پروتئینهای شناخته شده میباشد بر اساس به دست آوردن نقشه جرمی پپتیدها و آنالیز آنها در موتور جستجوگر MASCOT و در پایگاه دادههایی نظیر NCBI ،UniProt و ... است. در روش دوم که بیشتر برای شناسایی پروتئینهای ناشناخته کاربرد دارد، استفاده از روش MALDI-TOF/TOF یا LC-MS/MS میباشد. در این روش بعد از هضم آنزیمی پروتئین مورد نظر، پپتیدهای حاصل با ستون کروماتوگرافی جداسازی شده و سپس هر یک از پپتیدها را میتوان در دستگاه طیفسنجی جرمی شکست و طیف جرمی آن را بدست آورد. سپس با آنالیز طیف حاصل از شکستها به کمک موتورهای جستجوگر مانند MASCOT و SEQUEST و نیز به کمک نرمافزارهایی نظیر PEAKS میتوان پروتئین مورد نظر را شناسایی و توالییابی کرد.
آنالیز کیفی پروتیئنها: ابتدا پروتئین موردنظر با هضم آنزیمی به پپتید تبدیل شده و سپس با دستگاه LC-MS/MS و یا MALDI-TOF/TOF شکست های حاصل از پپتیدها بدست میآید. شناسایی پپتیدها و شکستهای آنها با نرم افزارها و موتورهای جستجوگر در دیتابیسها صورت میگیرد.
مطالعات کمی
مطالعات کمی پروتئینها بدون برچسب و یا با برچسب (شیمیایی یا متابولیکی) میباشد.
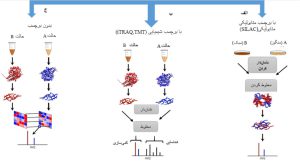
شکل 6: آنالیز کمی پروتئینها. الف– با برچسب متابولیکی، ب- با برچسب شیمیایی، ج- بدون برچسب.
بدون برچسب
کمیسازی بدون برچسب، روشی در طیفسنجی جرمی است که هدف آن تعیین مقدار نسبی پروتئین در دو یا چند نمونه بیولوژیکی است. بر خلاف روشهای دیگر برای تعیین کمیت پروتئین، کمیسازی بدون برچسب از یک ایزوتوپ پایدار حاوی ترکیبی برای اتصال شیمیایی به پروتئین و در نتیجه برچسبگذاری پروتئین استفاده نمیکند. در این روش ابتدا پروتئینهای هر حالت تحت شرایط یکسان استخراج و هضم آنزیمی میشوند و به صورت جداگانه طیف MS/MS آنها بدست میآید. کمیسازی پروتئینها بر اساس شدت یون و یا شمارش طیف MS/MS میباشد.
- هر طیف MS/MS که از طریق آن پروتئینی شناسایی شود یک شمارش برای آن پروتئین میباشد.
- شدت یون پپتیدهای مربوط به هر پروتئین اندازهگیری میشود.
شکل 7: شمای کلی آنالیز کمی پروتئینها بدون برچسب. ابتدا پروتئینهای هر نمونه (شاهد و تیمار) جداگانه هضم آنزیمی شده و طیف جرمی آنها بدست میآید. آنالیز کمی پروتئینها یا از طریق شمارش طیفهای حاصل از شکست پپتیدهای مربوط به هر پروتئین و یا از طریق اندازهگیری شدت یونهای مربوط به هر پروتئین بدست میآید.
آنالیز کمی پروتئین ها با برچسب شیمیایی
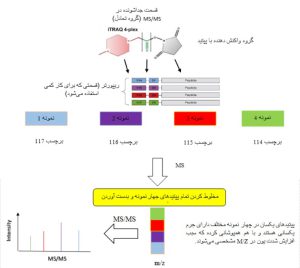
در این روش پپتیدهای حاصل از هضم آنزیمی پروتئینهای مربوط به هر نمونه با برچسبهایی مانند iTRAQ و TMT نشاندار میشوند. این برچسبها این امکان را فراهم میکنند که بتوان رفتار نمونهها را در زمانهای مختلف نیز بررسی کرد. برای مثال، در مورد برهمکنش پروتئین ـ پروتئین میتوان رفتار آن را در بازههای زمانی مختلف مطالعه کرد و تغییرات کمی را به دست آورد. برای مثال برچسب iTRAQ دارای هشت گروه ریپورتر است که بر مبنای آن میتوان هشت نمونه را همزمان مطالعه کرد. در مورد برچسب TMT این امکان تا ده مورد میباشد. نمونههای پروتئینی به صورت آنزیمی توسط یک پروتئاز هضم میشوند تا پپتید تولید کنند. سپس پپتیدهای هر نمونه با یک برچسب ایزوتوپی نشاندار میشود. نمونهها در نسبتهای معمولاً مساوی مخلوط میشوند و به طور همزمان طیف جرمی آنها بدست میآید. از آنجائیکه برچسبها ایزوباریک هستند و خواص شیمیایی یکسانی دارند، انواع ایزوتوپی برچسبها به صورت یک پیک ترکیبی منفرد در یک m/z در اسکن MS1 با زمانهای نگهداری کروماتوگرافی مایع یکسان ظاهر میشوند. در طی آنالیز کروماتوگرافی مایع ـ طیفسنجی جرمی (LC-MS/MS)، پپتیدهای شکسته شده یونهای محصول با توالی خاص تولید میکنند که میتوانند از قسمت ریپورتر برچسبها که طی شکست پپتیدها در MS/MS جدا میشوند شناسایی شده و برای تعیین مقدار نسبی پپتیدها استفاده شوند.
شکل 8: شمای کلی آنالیز کمی پروتئینها با برچسب شیمیایی. در این روش ابتدا پروتئینها با هضم آنزیمی به پپتید تبدیل شده و سپس مخلوط پپتیدها برای هر نمونه با یک برچسب شیمیایی مشخص نشاندار میشوند. سپس تمام پپتیدها با هم مخلوط شده و بعد از بدست آوردن شکستهای MS/MS از قسمت ریپورتر برچسب برای کار کمی استفاده میشود.
آنالیز کمی پروتئین ها با برچسب متابولیکی(SILAC):
برچسبگذاری ایزوتوپ پایدار با اسیدهای آمینه در کشت سلولی (SILAC) یک تکنیک مبتنی بر طیفسنجی جرمی است که تفاوتها را در فراوانی پروتئین در بین نمونهها با استفاده از برچسبگذاری ایزوتوپی غیر رادیواکتیو تشخیص میدهد. تفاوت برچسبدار کردن متابولیکی با شیمیایی آن است که ابتدا پروتئین نشاندار شده و سپس با هضم آنزیمی به پپتید تبدیل میشود. از معروفترین برچسبهای متابولیکی میتوان برچسب گذاری ایزوتوپ پایدار با اسیدهای آمینه در کشت سلولی (SILAC) را نام برد. برچسبگذاری ایزوتوپ پایدار با اسیدهای آمینه در کشت سلولی SILAC)) یک روش قدرتمند و پرکاربرد برای شناسایی و تعیین تغییرات نسبی در نمونه های پیچیده پروتئینی است. در این نشانگذاری معمولاً از Arg10 سنگین و Lys8 سنگین استفاده میشود و از آنجاییکه این دو اسید آمینه توسط آنزیم تریپسین شکسته میشوند قطعات خوبی را برای شناسایی و کمیسازی به دست میدهند. مشکل برچسبدار کردن متابولیکی این است که تنها برای کشت سلولی مناسب هستند و در مورد خون و بافت کاربرد ندارند بنابراین پروتئینهای زیادی را نمیتوان بررسی کرد مگر آنکه محیطهای سلولی مختلف را مخلوط و برچسبدار کرد تا بتوان تعداد پروتئینهای مورد مطالعه را افزایش داد. از سوی دیگر با SILAC تنها میتوان سه نمونه را همزمان مطالعه کرد.
شکل 9: آنالیز کمی پروتئینها با برچسب متابولیکی SILAC. دو جمعیت از سلولها در کشت سلولی کشت میشوند. یکی از جمعیتهای سلولی با محیط رشد حاوی اسیدهای آمینه نرمال تغذیه میشود. در مقابل، جمعیت دوم با محیط رشد حاوی اسیدهای آمینه با برچسب پایدار تغذیه میشوند. سپس پروتئینهای هر محیط، هضم آنزیمی شده و با طیفسنجی جرمی آنالیز کمی میشوند.
روشهای بدست آوردن دادهها در طیفسنجی جرمی برای مطالعه کمی پروتئینها
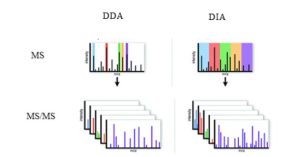
شاتگان و SWATH پروتئومیکس به استفاده از تکنیکهای پروتئومیکس از پایین به بالا در شناسایی پروتئینها در مخلوطهای پیچیده با استفاده از کروماتوگرافی مایع با عملکرد بالا همراه با طیفسنجی جرمی اشاره دارد. سپس از طیفسنجی جرمی متوالی برای شناسایی پپتیدها استفاده میشود. DDA و DIA دو روش اصلی برای مطالعه کمی پروتئینها میباشد.
- DDA: در این روش یک سری یون پیشرو برای شکست انتخاب میشود (shotgun).
- DIA در این روش تمام یونهای پیشرو شکسته میشوند (SWATH).
شکل 10: شمای کلی DDA-MS و .DIA-MS در DDA-MS، فراوانترین یونهای پیشساز بر اساس اسکن در MS1 انتخاب میشوند و یونهای انتخابی در MS2 شکسته میشوند. DIA-MS، اسکن لحظهای در MS1 ارائه میدهد. پنجرههای جداسازی گسترده از پیش تعریف شده، کل محدوده m/z در MS1 را پوشش میدهند و تمام یونهای پیشساز در هر پنجره ایزوله در MS2 شکسته میشوند.
پیش پردازش دادهها برای تجزیه و تحلیل آماری دادهها
دادههای خام حاصل از آزمایش پروتئومیکس کمی معمولاً برای تجزیه و تحلیل آماری مناسب نیستند. مشابه تجزیه و تحلیل دادههای بیان ژن، ابتدا پیش پردازش دادهها انجام میشود تا برای تجزیه و تحلیل آماری مورد استفاده قرار گیرند.
آمادهسازی و فیلتر کردن دادهها
قبل از هرگونه تجزیه و تحلیل آماری، دادههای حاصل از طیفسنجی جرمی با نرم افزارهای جستجوی پپتیدی پردازش میشوند. در این مرحله، توالی پروتئین/ پپتید مشخص شده و فراوانی پروتئینها به صورت کمی تعیین میشود. نرم افزارها معمولاً سطح اطمینانی از پپتیدها و پروتئینهای شناسایی شده را ارزیابی میکنند. به عنوان مثال، نرم افزار Protein Pilot میتواند برای پردازش دادههای تجربی iTRAQ استفاده شود. دادههای تجربی SILAC را میتوان با استفاده از MaxQuant پردازش کرد تا پپتیدها و به دنبال آن پروتئینها را شناسایی نمود. MAXQuant همچنین میزان خطای کاذب را برای شناسایی پروتئین و پپتید محاسبه میکند.
تبدیل
دادههای خام حاصل از آزمایشهای پروتئومیکس کمی به طور کلی توزیع نرمالی ندارند که این موضوع مانع استفاده از آنها در روشهای آماری متداول به دلیل نقض فرض نرمال بودن میشود. بنابراین، بیان پروتئین به گونهای تغییر میکند که مقادیر تبدیل شده فرض نرمال را برآورده کند. تبدیل کردن مقادیر به لگاریتم (log) بیشترین استفاده را دارد و همچنین برای تثبیت کردن مغایرت مقادیر پروتئین مفید است.
نرمال کردن
آزمایشهای پروتئومیکس معمولاً با تکرار همراه هستند تا تغییرات حاصل از شرایط آزمایشی و بیولوژیکی را کاهش دهند. نرمالسازی یک مرحله مهم پیش پردازش دادهها برای آزمایشهای پروتئومیکس است. نرمالسازی معمولاً با یک روش کالیبراسیون آغاز میشود که اطمینان میدهد دادههای آزمایشهای مختلف با شرایط بیولوژیکی یکسان، مقدار تمایل به مرکز (از نظر شاخص آماری) مشابهی دارند.
وارد کردن مقادیر از دست رفته
در آزمایشهای پروتئومیکس، پپتیدها به طور تصادفی با طیفسنج جرمی توالییابی میشوند و تنها زیرمجموعهای از پروتئینهای موجود را میتوان شناسایی کرد. هنگامی که از آزمایشهای پروتئومیک متعدد برای کمیسازی پروتئین استفاده میشود، بسیاری از پروتئینهای شناسایی شده در همه آزمایشها قابل تعیین نیستند. شناسایی و کمیسازی ناقص پروتئینها سبب از دست رفتن تعداد زیادی از دادههای خام پروتئومیک میشود. یک رویکرد تحلیلی ساده این است که فقط بر پروتئینهای دارای اطلاعات کمی کامل تمرکز شود تا از روشهای آماری استاندارد بتوان استفاده کرد. با این حال، این امر منجر به از دست رفتن اطلاعات به دلیل حذف دادههای ناقص میشود. یک روش جایگزین، محاسبه مقادیر از دست رفته بر اساس مقادیر موجود با استفاده از میانگین مقدار بیان همان پروتئین میباشد. روشهای پیچیدهتر از مقادیر موجود از سایر پروتئینهای مرتبط برای محاسبه مقدار پروتئینهای از دست رفته استفاده میکنند.
تجزیه و تحلیل آماری و بیولوژیکی دادهها
بررسی تفاوت در پروتئینهای بیان شده در نمونهها
یکی از رایجترین اهداف آزمایشهای پروتئومیکس، کشف رابطه متقابل بین بیان پروتئومیکس و گروههای نمونه خاص است. یک مثال ساده، مقایسه پروفایلهای بیان پروتئین در دو یا چند نوع مختلف شرایط بیولوژیکی مانند گروه شاهد و گروه تیمار شده است.
بررسی وابستگی تغییرات پروتئینها به زمان
آزمایشات پروتئومیکس برای مطالعه تغییرات در سطوح بیان پروتئین در طول زمان مورد استفاده قرار میگیرند. به عنوان مثال، سطح بیان پروتئین از نمونهها در دورههای زمانی مختلف اندازه گیری میشود. در مقایسه با آزمایشهای پروتئومیکس انجام شده در یک نقطه زمانی ثابت، آزمایشهای پروتئومیکس که روند زمانی را مطالعه میکنند، بر ارزیابی اثرات زمان، اثرات درمان و تعامل بین زمان و درمان تمرکز خواهند کرد.
مقایسه چندگانه پروتئینها و محاسبه FDR
فرآیند تشخیص پروتئینهایی با بیان متفاوت شامل آزمایش فرضیهها بر روی چندین پروتئین است. برای هر مقایسه روی یک پروتئین، دو نوع خطا ممکن است رخ دهد. خطای نوع اول زمانی رخ میدهد که پروتئینی بدون بیان متفاوت باشد و به اشتباه اعلام شده است که به طور متفاوت بیان میشود. خطای نوع دوم زمانی رخ می دهد که پروتئینی اعلام شود که بیان متفاوتی ندارد در حالیکه در واقع بیان متفاوتی وجود دارد.
بررسی وابستگی بین پروتئینها
هدف آزمایشی مهم دیگر از مطالعات پروتئومیکس، تعیین وابستگی بین پروتئینها است. تجزیه و تحلیل خوشهای فرض میکند که پروتئینهایی با عملکردهای بیولوژیکی مشابه الگوهای بیان پروتئین مشابهی دارند و پروتئینها را در خوشههای مختلف تقسیم میکند؛ به طوریکه پروتئینهای یک خوشه در مقایسه با پروتئینهای موجود در خوشههای مختلف، الگوهای مشابهی از سطوح بیان پروتئین دارند. یعنی پروتئینهای یک خوشه، الگوهای مشابهی از سطوح بیان پروتئین را در مقایسه با پروتئینهای موجود در خوشههای مختلف به اشتراک میگذارند.
تجزیه و تحلیل مؤلفههای اصلی
تجزیه و تحلیل مؤلفه اصلی یک روش آماری پرکاربرد در آنالیز دادههای طیفسنجی جرمی به منظور کاهش ابعاد و تجسم خوشهبندی است. به طور خاص، تجزیه و تحلیل مؤلفه اصلی از یک تبدیل متعامد برای شناسایی اجزای اصلی استفاده میکند. انتظار میرود که مؤلفههای اصلی شناسایی شده، بیشترین تغییرپذیری دادههای نمونههای مختلف را به خود اختصاص دهند. بنابراین، میتوان از مؤلفه اصلی شناساییشده برای تشخیص زیرمجموعههای نمونه یا پروتئینی که مسئول اکثر تغییرات بین گروهها هستند، استفاده کرد و به طور مؤثر ابعاد دادهها را کاهش داد.
نرم افزارهای رایج در مطالعات کمی پروتئومیکس
دادههای کمی پشتیبانی شده | انواع | نرم افزار |
SILAC,iTRAQ,TMT و آنالیز کمی بدون برچسب، برچسب گذاری با دی متیل | نرم افزار تجاری شرکت ترمو فیشر ساینتیفیک | Proteome discovery |
SILAC,iTRAQ,TMT و آنالیز کمی بدون برچسب، برچسب گذاری با دی متیل | دسترسی رایگان | MaxQuant |
SILAC,iTRAQ,TMT و آنالیز کمی بدون برچسب، برچسب گذاری با دی متیل، برچسب O18 و N15 | دسترسی رایگان | Census |
SILAC, iTRAQ, ICAT | دسترسی رایگان | TPP |
SILAC و برچسب N15 | دسترسی رایگان | pQuant |