جدول محتوا
فرمول كلي محاسبه سلول برای یک چاهک
Requirement Stock
) cell line (مقدار مورد نياز (مقدار موجود از سلول)
Concentration of cells you need× final volume = Concentration of cell in stock × volume that you have to take from stock
نكته: بايد دقت داشت كه غلظت Stock بیش از Requirement باشد. همچنين واحدها يكسان باشند.
نمونه سوال
فلاسك T25 حاوی 3 ميليون سلول است. سلولها تریپسینیزه و در ml5 محیط کشت حل میشوند. اگر بخواهیم 50 هزار سلول را در هر خانه پليت 24 خانهای بریزیم و محیط کشت نهایی آن رابه ml1 برسانیم، چه حجمی از ml5 را باید برای یک خانه استفاده کنیم؟5 x 104cell/ml × 1ml = 3 x 105 cell/ml x X
x = 0.083 mL = 83µl
بنابراین، باید lµ 83 را به حجم ml1 رسانید و آن را در یک خانه از پلیت قرار دهید.پاساژ-نامبر (Passage Number)
هنگامي كه تعداد سلول در ظرف كشت به 80-75% رسيد، باتوجه به اندازة ظرف و رشد سلولها به چند (X) ظرف تقسيم میشوند. این تقسیم اول پاساژ-نامبر 1 نام دارد. اگر باز هر یک از اين ظروف به ظروف ديگر تقسيم شود، تقسیم پاساژ-نامبر 2 نامیده میشود و به همین ترتيب ادامه میيابد. پاساژ نامبر معمولاً روی شناسنامه سلول در بانك سلولی ذكر میشود.
پيری در اثر همانندسازی (Replicative senescence or Hayflick’s limit)
اولين دانشمندی كه متوجه شد سلولهای فيبروبلاست پس از پیشروی تا چند پاساژ، ديگر شرايط روز اول را ندارند، رشد نميكنند و میميرند، هیفلیک بود. البته فاز ثابت Staturation در هر سلولی وجود دارد، اما در اينجا ديگر سلول تقسيم نمیشود. این فرایند اصطلاحاً سلول پير میشود. هیفلیک متوجه شد كه سلولهای سوماتيك (غير بنيادی) كه در آنها تلومراز فعاليتی ندارد، در تكثير محدود هستند مثلا پس از 60 بار تكثير ديگر تكثير نمیشوند. كه اين محدوديت يا ماكزيمم طول عمری كه سلولها را میتوان در محيط كشت نگهداشت پيری سلول یا Senescent) (Hayflick’slimit گويند.
عوامل بروز پيری سلول در شرايط In vitro
ـ قرار گرفتن سلول در شرايط استرس (stress) مثل شرايطی كه سلولها بيش از اندازه كنار هم باشند، فضا برای آنها کم باشد و محيط مغذی به آنها نرسد يا مواد سمی توليد كنند.
ـ كوتاه شدن تلومر
تلومر قسمتي از DNA در انتهای كروموزم است. (دو جفت تلومر در هر كروموزوم وجود دارد كه از انتهای كروموزوم محافظت میكنند.)
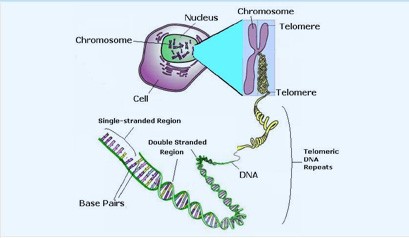
در هر بار تقسيم كروموزوم، كمي از تلومرها كوتاه میشود تا زمانی كه سلول به مرحله بحرانی وارد شده و پيری اتفاق میافتد. اگر ژن بیانکننده آنزيم تلومراز وارد ژنوم سلول شود، از پيری سلول جلوگیری میشود (يكی از روشهای نگهداری يا ميراسازی سلول).
بهطور كلي طول تلومر مانند يک ساعت بيولوژيکی عمل میکند و کوتاه شدن آن تا حد مشخصی ادامه مییابد. هنگامیكه طول تلومر به حد بحرانی برسد، سلول ديگر نمیتواند تکثير شود. در سلولهای توموری طول تلومر با تلومراز افزايش میيابد. این جریان مانع از پيری سلولها میشود.
نكته: آنزيم تلومراز بهصورت طبيعی در سلولهای سوماتيك سركوب شده است، ولی در سلولهای سرطانی بهصورت غير معمول فعال میشود و سلول همانند يک انكوژن عمل میکند.
تغييرات احتمالی با افزايش پاساژ نامبر در سلول
– تغيير در مورفولوژی سلول (بزرگ یا عریض شدن سلول)
– تغيير در پاسخ سلول به تحريكات (معمولاً پاسخ سلول كاهش مییابد).
– تغيير در ميزان رشد سلول: افزايش زمان دوبرابر شدن سلول (PDT) در مقایسه با حالت عادی (24 ساعت به بالا)
– تغيير در بيان پروتئين
– تغيير در ترانسفكشن و سيگنالينگ
تکنيکهای گندزدايی (Aseptic technique)
با وجود آنتیبيوتيکها، آلودگیهای ناشی از لاشههای ميکروارگانيسمها (باکتریها، مايکوپلاسما، مخمر و يا اسپور قارچ) در کشت سلول بسیار مهم است. اين آلودگیها همراه آزمايشگر یا از راه هوا، سطوح کار و محلولها به محيط کشت وارد میشود و ممکن است يک يا دو کشت سلولی يا همه محيط آزمايشگاه را آلوده کند. با رعايت اصول زیر میتوان از میزان آلودگی کشت سلول کاست:
- بررسی مکرر محيط کشت از نظر آلودگی با ميکروسکوپ فاز کنتراست.
- آشکارسازی آلودگیهای پنهان محيط کشت با نگهداری مدت زمان کوتاهی بدون آنتیبيوتيک در دمای 37 درجه سانتیگراد
- انحصار ظروف کشت به آزمايشگر و يا يک تيره سلولی
- اطمينان از استريل بودن بافرهای مورد استفادة توليدکننده يا آزمايشگر
- حفظ تکنيکهای استاندارد استريليتی در زمان انجام کار
تشخيص آلودگیهای مايکوپلاسمايی با ميکروسکوپ معمولی ممکن نيست. این آلودگیها اگر تشخیص داده نشوند، آزمايشگاه و کشتهای ديگر را آلوده میکند. بنابراين، پیش از شروع کار بهويژه در مورد سلولهايی با رشد غيرطبيعی، تست مايکوپلاسما ضروری است.
تکنيک گندزدايی سدی را بين ميکروارگانيسمهای موجود در محيط بيرون کشت و محيط کشت عاری از آلودگی درون ظرف آزمايش يا فلاسک تولید میکند. از اين رو بايد همه موادی که در تماس مستقيم با کشت سلولاند استريل شوند. به صورتی که ارتباطی بين کشت سلول با محيط غير استريل وجود ندشته باشد.
اگرچه امروزه شرايط آزمايشگاههای مدرن بهبود يافته است (کولر، فيلتر، هود لامينار و … )، در این مکانها ازدحام جمعيت بيشتری دیده میشود و این امر حفظ استريليتی در آنها را بسيار مشکل میکند.
| GOOD ASEPTIC TECHNIQUE | ||
| DO | DON’T | |
| Glassware | Keep stocks separate(blue caps) | Use for chemmical |
| Laminar flow hoods | Book | Overbook & not use |
| Keep minimum in hood | Culture up the hood | |
| Swap down before and after | Leave it in a mess | |
| Contamination | Work without antibiotics if possible | Open contaminated flasks in tissue culture |
| Box open plates | Leave contaminations unclairned | |
| mycoplasma | Test cell routinely | Carry infected cells |
| Try to decontaminate | ||
| Importing cell lines | Check for mycoplasma | |
| Validate origin | ||
| Keep records | ||
| Exporting cell lines | Check for mycoplasma | |
| Validate origin | ||
| Send data sheet | ||
| Triple wrap | ||
| Flasks | Vent briefly if stacked | Stack too high |
| Pipettes | Use plastic for agar | Overfill hods |
جداسازی سلولها برای کشت اوليه
کشت اوليه را برای تهيه تيرههای سلولی استفاده میکنند که از بافتهای مختلف بدن جاندار يا جنين گرفته میشود. به دليل تمايزيافتگی کمتر سلولهای جنينی بهتر است از جنين برای کشت اوليه استفاده شود. به اين منظور مراحل تهيه سلولها برای کشت اوليه از جنين موش، جنين مرغ و در مورد انسان از طريق بيوپسی بافت مورد نظر شرح داده میشود.
مراحل جداسازی جنين موش برای کشت اوليه
1- موشهای نر و ماده را به منظور جفتگيری در يک قفسه قرار میدهیم، برای اطمينان از جفتگيری موفق هر صبح موشهای ماده معاينه واژينال پلاک میشوند. وجود موکوس سفت اطراف دهانه واژن نشاندهنده حاملگی است. روز تعيين پلاک روز صفر در نظر گرفته شده و از اين روز به بعد تکامل جنين آغاز میشود. حدود 20-19 روز بعد دوره آبستنی کامل میشود. روز مناسب برای جداسازی جنين از رحم مادر روز سيزدهم آبستنی است در اين زمان بخش زيادی از مزانشيم تمايزنيافته و بيشترين سلول کشت از آن به دست میآيد. (بيشتر اندامها به جز قلب و مغز روز نهم آبستنی میگیرد اما تا روز يازدهم نمیتوان آنها را جدا کرد. به طورکلی موش را در روز سيزدهم و چهاردهم راحتتر میتوان تشريح کرد. اندامها تا روز هجدهم کاملاً شکل گرفتهاند.)
2- موشها را با کشيدگی (جابجايی) گردن کشته و سطح شکمی را با الکل 70% تميز مینماییم، پوست شکم را به صورت افقی در خط ميانی بالای ديافراگم پاره کرده سپس پوست هر دو سمت پارگی را گرفته و به سمت مخالف میکشیم تا ديواره شکمی دستنخورده نمايان شود.

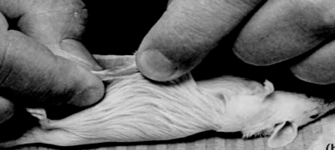

3- با قيچی استريل در امتداد خط ميانی برش طولی داده تا احشا آشکار شوند. در اين مرحله رحم پر از جنين از پشت مشخص است. قطعات را درون يک تيوب دربدار 50-25 ميلیليتری حاوی 20-10 ميلیليتر BSS وارد نموده (در صورت احتمال آلودگی میتوان به BSS آنتی بيوتيک اضافه کرد.) و درب آن را میبندیم.
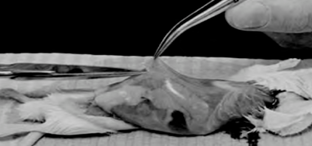
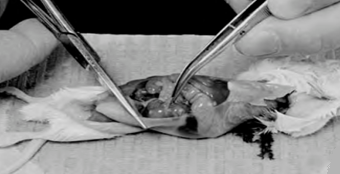
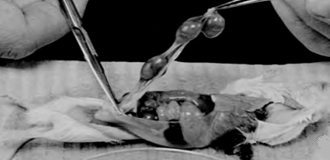
همه مراحل بالا بايد بيرون از آزمايشگاه کشت انجام شود. يک هود لامينار کوچک و تکنيک سريع به نگهداری استريليتی کمک میکند. حيوان زنده در آزمايشگاه کشت برده نمیشود. تکه بافت حيوان را پس از غوطهورسازی در الکل بعد از استفاده به سرعت دور میریزیم.
4- رحم سالم را به آزمايشگاه کشت برده و به يک ظرف استريلشده با BBS انتقال میدهیم.
5- تشريح جنين (شکل 1-18 و 1-19). با دو پنس استريل رحم را پاره میکنیم. برای جلوگيری از پيچش رحم و فشار بر جنين دو لبه پارهشده را نزديک هم نگه میداریم. جنينها را از جفت جدا کرده و در يک سمت ظرف قرار میدهیم. سپس، آنها را به ظرف ديگری منتقل مینماییم. درصورتيکه به تعداد زيادی جنين نياز باشد (بيش از 4 يا 5 نوزاد در يک زايمان)، بهتر است ظرف حاوی جنينها برای تشريح و کشت بعدی روی يخ قرار داده شود.
پس از ريزريز کردن (Chopping) با چاقوی شماره 11 جراحی، به کمک آنزيم يا به صورت مکانيکی سلولها را جدا کرده و کشت میدهیم.
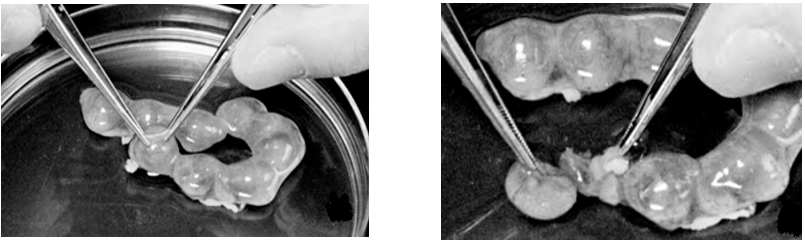
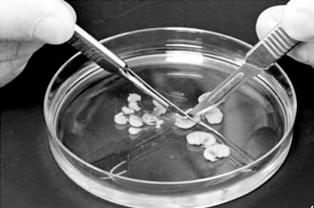
مراحل جداسازی جنين مرغ برای کشت اوليه
1- تخممرغ را در دمای 38.5 درجه سانتيگراد در هوای مرطوب انکوبه کرده و تخممرغ هر روز 180 درجه چرخانده میشود. اگرچه حدود روز 21-20 جوجه به دنيا میآيد اما طول مراحل تکاملی آن با موش متفاوت است. برای کشت اوليه سلولهای جدا شده از جنين تخممرغ، بهتر است نمونه سلولی در روز هشتم گرفته شود. اما جداسازی اوليه اندام در روز دهم تا سيزدهم انجام میشود.
2- انتهای بالايی تخممرغ را با الکل 70% ضدعفونی نموده و سپس آن را روی يک بشر کوچک قرار میدهیم.

3- پوستة نوک تخممرغ را میشکافیم و با استفاده از پنس پوسته را برداشته تا پرده سفيد زيری نمايان شود.

4- پنس را با قراردادن در BSS استريل یا فروبردن مجدد در يک بشر الکل استريل کرده و پرده سفيد زير پوسته را برمیداریم تا پرده کوريوآلانتوئيک با عروق خونی آن نمايان شود.
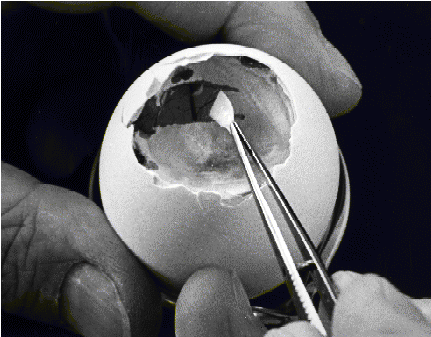

5- پرده کوريوآلانتوئيک را با نوک خميده استريل یک پنس سوراخ کرده و زیر گردن جنين را گرفته و به آرامی بيرون میکشیم. باید دقت شود پنس بسته نشده و به گردن جنين فشار نياورد.

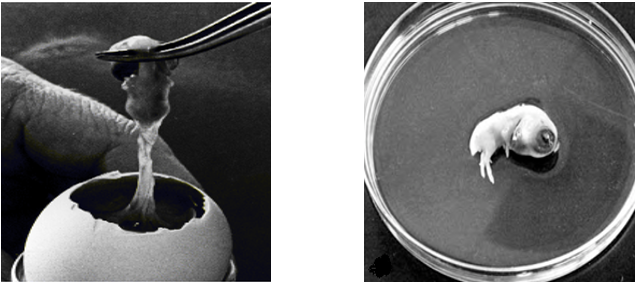
6- جنين برای تشريح و کشت به يک پتریديش 9 سانتیمتری حاوی 20 ميلیليتر DBSS (Dissection BSS) انتقال داده میشود. بعد از ريزريز کردن (Chopping) به کمک آنزيم يا به صورت مکانيکی سلولها را جدا کرده و کشت میدهیم. (DBSS: همان BSS با غلظت u/ml 200 آنتیبيوتيک پنیسیلین و استرپتومایسین)
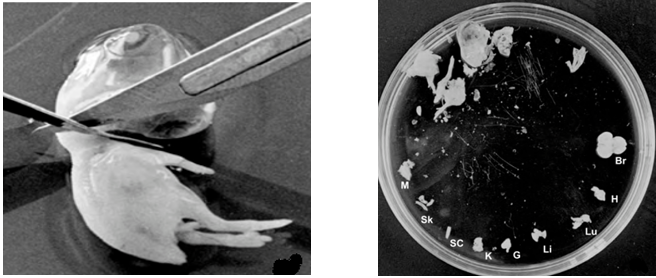
مراحل جداسازی بافت انسان برای کشت اوليه
برای تهيه سلولهای اوليه از بافت انسانی باید نمونهبرداری صورت گيرد. اين کار مستلزم جلب موافقت 1- کميته اخلاق بيمارستان 2- اساتيد جراح 3- بيمار يا بستگان بيمار است. نمونهبرداری فقط برای اهداف تشخيصی صورت میگیرد. از اينرو، بايد در ابتدا يک پاتولوژيست آن را ببيند. در مورد بافتهای غير پاتولوژيکی مانند جفت يا بند ناف به این کار نيازی نيست. انتقال نمونه گرفتهشده به آزمايشگاه، دريافت نمونه، گزارش جزئيات نمونه باید طبق برنامهای منظم صورت گيرد تا بافت فاسد از بين نرود. بهتر است نمونه بافتی در هود کلاس دو قرار داده شود و همه لوازم کار با اتوکلاو کردن يا فرو بردن در يک ماده ضدعفونی مناسب استريل شوند. در صورت امکان نمونه بافتی از لحاظ عفونتهايی مانند هپاتيت، ايدز، سل و … غربال شود مگر اينکه بيمار نمونهدهنده، قبلاً آزمايش داده باشد.
مراحل جداسازی به صورت زیر است:
1- ظرف حاوی محيط کشت را با درج نام و نشانی آزمايشگر آماده نموده و نمونه بافتی را پس از جراحی درون آن قرار میدهیم.
2- نمونه را به آزمايشگاه کشت سلول انتقال میدهیم. در صورت نگهداری نمونهها در دمای 4 درجه سانتیگراد بافت به مدت حداقل 24 ساعت زنده میماند. هرچه زمان نمونهبرداری تا کشت بيشتر باشد، شانس زنده بودن بافت کاهش میيابد.
3- گرچه عمل جراحی فرايندی استريل میباشد، پیش از نمونهبرداری به بيمار آنتیبيوتيک خوراکی داده و محل نمونهبرداری با ماده ضدعفونی شسته میشود. اين کار بهخصوص برای نمونهبرداری از بافتهای کولون و رکتال يا پوست لازم است.
چنانچه نمونة بافتی گرفتهشده بزرگ باشد (mg 200 يا بيشتر)، به مدت کوتاهی (30 ثانيه تا يک دقيقه) در الکل 70% فروبرده میشود تا آلودگیهای سطحی کاهش يابد.
در نهايت برای شناسايی سلول جداشده با تکنيکهاي زير نشاندار و مشخص میشوند:
1- MACs (Magnetic activating cell sorting) مثل CD133
2- FACs (Fluoresnt actinating cell sorting) مثل SSEA4
3- انتخاب محيط اختصاصی براي رشد سلول مورد نظر مانند کراتينوسيت که از محيط KGM (keratinxyte growth medium) استفاده میشود.
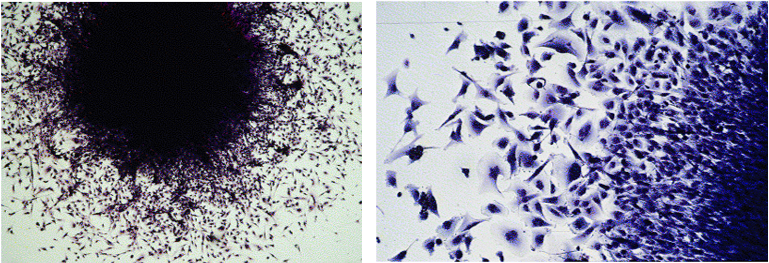
جداسازی سلول های بافت برای کشت اوليه در In vitro
پس از قطعهقطعه کردن بافت، سلولهای آن را به کمک روش مکانيکی مانند عبور دادن قطعات بافت از الکهای پلاستيکی استريل (شکل 1ـ 27) يا روش آنزيمی با آنزيمهای پروتئوليتيک مانند تريپسين، کلاژنازI ، کلاژنازIV و ديسپاز آزاد میکنیم و درون ظرف کشت يا فلاسک کشت میدهیم.
