جدول محتوا
متابولومیکس
- دسته بندی: مطالعات امیکس
- نویسنده: مدیر ایده زیست
جدول محتوا
امروزه علاقه فراوانی به شناخت عمیق مکانیسمهای بیولوژیکی وجود دارد که این مطالعه نهتنها در سطوح مولکولی (اجزای بیولوژیک)، بلکه اثرات یک فرایند بیولوژیکی در حال انجام در ارگانیسم (عملکرد بیولوژیکی) را هم شامل میشود که بهاصطلاح ذیل مفهوم زیستشناسی سامانهای (system biology) تعریفشدهاند. در این زمینه، متابولومیکس یکی از قویترین استراتژیهای تحلیل است که میتوان با استفاده از آن تصویری از متابولیتهای یک موجود زنده و یا از نمونههای مرتبط با ساختارهای حیاتی طی یک فرایند زیستی را به دست آورد. متابولومیکس بهعنوان یک تکنیک «اومیکس» در زیست شناسی سامانه ای، اندازه گیری کمی و همزمان کلیه متابولیت های یک سیستم بیولوژیکی مانند سلول است. این فرایند با دو رویکرد شناسایی و اندازهگیری گروهی متابولیت ها و ایجاد شناسنامه متابولیتی و رویکرد دیگری بهصورت اندازه گیری یا شناسایی یک متابولیت خاص در سلولها، بافت ها و مایعات بیولوژیکی انجام می گیرد. جهت بررسی متابولیت ها در متابولومیکس بهطور عمده از دو روش اسپکترومتری جرمی و اسپکتروسکپی رزونانس مغناطیسی هسته استفاده می شود. متابولومیکس تکنیکی تخصصی است که چندین مرحله را شامل می شود:
1) تهیه انگشتنگاری متابولیتی که در این روش سعی می شود تمامی متابولیت های قابلاندازهگیری بهصورت شناسنامه وار توسط تکنیکهای جداسازی و شناسایی، تشخیص داده شوند.
2) تعیین پروفایل متابولیتی که هدف آن بررسی و اندازه گیری تعدادی متابولیت با ساختار معلوم یا مجهول که همگی معمولاً از یک مسیر متابولیکی به دست میآیند.
3) آنالیز ایزوتوپ محور هدفمند که تمرکز آن بر قسمت خاصی از متابولوم (یک یا چند مسیر متابولیتی مشخص) در سیستم مورد مطالعه است که چندین متابولیت را از طریق ردیابی ایزوتوپی دنبال میکند. بهطور خلاصه روشهای متابولومیک، شامل شناسایی و تعیین مجموعهای از متابولیتها در موجود زنده یا نمونههای بیولوژیکی (بافت، سلول، مایعات یا ارگانیسمها) در شرایط عادی و در مقایسه با حالتهای تغییریافته توسط بیماری، درمانهای دارویی، مداخلات در شرایط طبیعی زیستی (مثل رژیم غذایی) میباشد. بررسی متابولیتها عمدتاً توسط دستگاههایNMR ، GC-MS و LC-MS امکانپذیر است. مجموعه دادههای حاصل از ارزیابی متابولیت ها با روشهای مذکور از طریق تجزیهوتحلیلهای چند متغیری و نرمافزارهای پیشرفته آماری پردازششده و خروجی آنها مورد استفاده محققین قرار می گیرد.
مقدمه
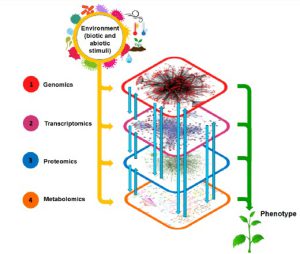
استراتژیهای اومیکس در زمینههای متنوعی ازجمله تشخیص بیومارکرهای مربوط به تشخیص، پیشرفت بیماری، بازدهی درمانهای متفاوت و عموماً جهت درک فرآیندهای بیولوژیکی و قوانین آنها به کار میروند. هنگامیکه صحبت از اومیکس به میان میآید: ژنوم به معنی کلیه اطلاعات ژنتیکی است؛ ترنسکریپتوم مربوط به مجموع رونوشتهای RNA تولید شده توسط ژنوتیپ در یک زمان خاص و شرایط معین بوده و پیوندی میان ژنوم، پروتئوم و فنوتیپ سلول یا موجود است؛ پروتئوم اشاره به کلیه پروتئینهای بیان شده در سلول، بافت یا ارگانیسم دارد؛ متابولوم مربوط به کلیه متابولیتها است که در حوزه اومیکس بهترتیب به آنها ژنومیکس، ترنسکریپتومیکس، پروتئومیکس و متابولومیکس گفته میشود. واژههای دیگری مثل لیپیدومیکس (مطالعه مولکولهای لیپیدی) و دگرادومیکس (مطالعه ترکیبات حاصل از تخریب پروتئینها)، Interactomics (مطالعه برهمکنش بین مولکولها)، گلایکومیکس (مطالعه قندها)، ولتایلومیکس (مطالعه ترکیبات فرار گیاه) نیز در سالهای اخیر ابداع شدهاند. اصطلاح متابولومیکس نیز بهعنوان روشی برای اندازه گیری متابولیتهای موجودات زنده در پاسخ به محرکهای بیرونی تعریف میشود.
عبارت «آنالیز متابولوم» در سال ۱۹۹۸ زمانی که محققین روی بررسی تأثیر بیان ژنهای مخمر در مقدار متابولیت های استخراجشده از آن کار میکردند، تعریف شد. در همان سال، دانشمندان دیگری از آنالیز متابولوم برای بررسی متابولیتهای E.Coli برای دسته بندی فنوتیپ آنها استفاده کردند. یک سال بعد واژه متابولومیکس را نیکلسون و همکاران بهعنوان اندازهگیری کمی پاسخ متابولیتی ارگانیسم زنده نسبت به محرکهای پاتوفیزیولوژیکی یا تغییرات ژنتیکی تعریف کردند.
تاریخچه متابولومیکس و اهمیت آن در زیست شناسی سامانه ای
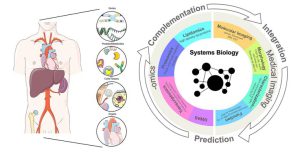
بعد از پیدایش مفهوم زیستشناسی سامانهای، روشهای تجزیه زیستی زیادی که در فرایند تشخیص تعاملات بین مولکولهای بیولوژیکی و تأثیر آنها بر عملکرد یک ارگانیسم نقش مهمی ایفا میکنند، به وجود آمده و یا پیشرفت قابلتوجهی داشتهاند. زیستشناسی مولکولی و فیزیولوژی، بیشتر برای به دست آوردن اطلاعات بیوشیمیایی و بیومولکولی و اطلاعات کاربردی مورد استفاده قرار میگرفتند؛ بااینحال هر دو استراتژی مولکولی و فیزیولوژی، تنها دادههای محدودی را با توجه به بیومولکول هدف فراهم میکردند که قادر به توصیف یک سیستم زیستی بهصورت کامل و یکپارچه نبود. به همین دلیل توسعه استراتژیهای اُمیکس موجب انقلابی در این حیطه علمی شد و امروزه بهطور گسترده در فرایند زیستشناسی سامانهها مورد استفاده قرار میگیرد.
در دهههای اخیر، تحقیقات در زمینه ژنومیکس بهسرعت گسترش یافته و علاوه بر این، مطالعه عملکرد ژنها با بررسی مولکولهای RNA به شکل علمی و عملی آغاز شده است. استفاده از فناوری ترنسکریپتومیکس و سپس ارزیابی پروتئینهای تولیدشده (فناوری پروتئومیکس) با استفاده از میکروچیپها با کارآیی بالا، توانایی دانشمندان را در مطالعه اساس مولکولی سلول، بافت و کل موجود زنده در حالت سلامت و بیماری افزایش داده است.
زیست شناسی سامانه ای، از طریق نگرش بالا به پایین و کلینگر بر مسائل زیستی، سعی در رسیدن به درک بهتری از زیستشناسی و مکانیسمهای آن، بهویژه از عملکردها و برهمکنش های عناصر کلیدی سیستمهای زنده (DNA، RNA، پروتئینها، سلول) دارد. این زیست شناسی سامانه ای است که سعی دارد رفتار یک شبکه پیچیده زیستی پویا را در شرایط مختلف و زمانهای متفاوت پیشگویی و شبیهسازی کند و ارتباطهای اجزای یک مکانیسم پیچیده تنظیمی و حتی بین شبکهها و بخشهای یک سیستم زیستی را بیابد.
یکی از مهمترین شاخههای زیستشناسی سامانهای، تعیین و اندازهگیری متابولیتها است که بهعنوان متابولومیکس شناخته میشود. این تکنولوژی برای اندازهگیری تمام محصولات متابولیک با وزن مولکولی کم در گیاهان، جانوران، باکتری ها و قارچ به کار میرود. در مورد انسان، از آنجا که وضعیت متابولیت های مایعات بدن، سلول ها و یا باف تها معیار فیزیولوژیک و پاتولوژیک مهمی بهخصوص در بیماریهای پیچیده هستند؛ متابولومیکس میتواند نقش مهمی در شناخت بیماریها ایفا کند. متابولومیکس اساساً به اندازهگیری و تجزیهوتحلیل هزاران مولکول کوچک مشتق شده از قندها، پروتئینها و چربیها که محصولات متابولیکی یک موجود هستند، میپردازد. برخلاف تحلیلهای آزمایشگاهی متداول که در جستجوی متابولیت های شناختهشده و از قبل معلوم شده هستند، هدف متابولومیکس بررسی تمام محصولات متابولیک موجود در بدن یک سیستم زنده بدون هیچ پیشداوری و انتخاب (بر پایه یک یا چند ماده متابولیکی مورد نظر) است. این روند را اصطلاحاً پیشبینینشده یا غیر هدفمند میگویند و درواقع شناسایی متابولیتهایی است که از قبل شناسایی نشدهاند. نکته مهم این است که این روش سریعتر و برای تعداد بیشتری از بیماران یا نمونههای تیمار شده مورد بررسی قابل انجام بوده و از لحاظ تشخیصی هم بسیار قابل اطمینان است.
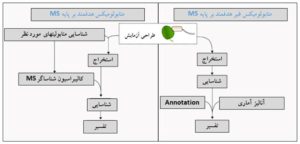
شکل 4ـ مقایسه استراتژی هدفمند و غیر هدفمند در متابولومیکس بر پایه اسپکترومتری جرمی
گرچه متابولومیکس بهعنوان یک زمینه نسبتاً جدید در نظر گرفته میشود اما ۵۰۰ سال قبل از میلاد بقراط اولین کسی بود که عملکرد بدن انسان را بر اساس ویژگیهای ادرار تفسیر کرد. بهعلاوه، برخی از گزارشها نشان میدهد که تاریخچه تشخیص مبتنی بر ادرار به دوران قبل از بقراط بازمیگردد. باور عمومی بر این است که یکی از تمدنهای اولیه در ۴۰۰۰ سال قبل از میلاد، ویژگیهای تغییریافته ادرار در برخی بیماریها را تشخیص داده است.
در طب هندو نیز چنین بیان میشود که ادرار برخی افراد شیرین است و مورچههای سیاه بهطرف این ادرار شیرین جذب میشوند، که در حال حاضر این موضوع بهعنوان نشانهای از بیماری دیابت شیرین طبقهبندی میشود. در چین باستان، از مورچهها برای تشخیص دیابت افراد از روی ادرار آنها استفاده میشده است. در قرونوسطی هم از نمودارهای ادراری که بو، طعم و رنگ ادرار را به یکدیگر مرتبط میکردند برای تشخیص بیماریهای مختلف در پزشکی استفاده میشده است.
مطالعات مربوط به مفاهیم متابولومیکس، برای اولین بار در مقالات در اواخر دهه ۱۹۴۰ توسط ویلیامز و همکارانش گزارش شده است. این مطالعات بر اساس دادههای بیش از 200 هزار کروماتوگرام کاغذی است که از نمونههای مایع بدن سوژههای مختلف، شامل افراد الکلی و اسکیزوفرنیک برداشته شده است. شواهد نشان میدهد که با توجه به فرضیه «شخصیت بیوشیمیایی» الگوهای متابولیکی مشخصی در ارتباط با هریک از این گروهها وجود دارد. در سال ۱۹۷۱، هورنینگ «تشریح متابولیکی» را برای اولین بار بهعنوان ارزیابی تعداد کمی از متابولیتهای از پیش تعیین شده برای بررسی مسیرهای بیوشیمیایی توصیف کرد که در واقع تشریح متابولیکی را میتوان نوعی متابولیک هدفمند دانست.
اصطلاح متابولوم برای اولین بار در مقالات در سال ۱۹۹۸ ظاهر شد؛ زمانی که الیور و همکاران تغییر غلظت نسبی متابولیتها در نتیجه حذف یا بیان بیش از حد ژن را اندازهگیری کردند. متابولوم شامل مجموعه متابولیتهای یک موجود زنده است که محصول نهایی بیان ژنها هستند. متابولیتها بهوسیله واکنشهای آنزیمی تولید میشوند و دارای اثرات مستقیم بر روی فنوتیپ سلولها هستند. در سال ۲۰۰۱، متابولومیکس توسط فین بهعنوان تجزیه و تحلیل جامع و کمی از تمام متابولیتهای سیستم بیولوژیکی مورد مطالعه تعریف شد.
در سال 2002، نیکلسون و همکاران از واژه «متابولومیکس» استفاده نمودند که به اندازهگیری کمی متابولیت ها در واکنش به یک محرک بیماریزا یا غیر بیماریزا و یا تغییرات ژنتیکی در یک سیستم زنده اطلاق میگردد. تغییرات در سطوح متابولیتی درونی که ممکن است ناشی از فرایندهای بیماری، سمیت، یا عملکرد ژنی باشد، در سلولها، بافت ها و یا مایعات بیولوژیکی بهوسیله متابولومیکس بررسی میشود. در دهه گذشته اصطلاحات دیگر در مقالات برای طبقهبندی مطالعات متابولیسم ظاهرشده است.

آنها از کروماتوگرافی گازی ـ طیفسنجی جرمی (GC-MS) برای اندازهگیری متابولیتها در ادرار و عصارههای بافتی انسان استفاده کردند. از اوایل دهه ۱۹۷۰ تا اوایل دهه ۱۹۸۰ هورنینگ همراه با پولینگ و رابینسون، تکنیکهای مبتنی بر GC-MS را برای اندازهگیری متابولیتها در مخلوطهای بیولوژیکی توسعه دادند. اصطلاح اثرانگشت متابولیکی توسط فین بهعنوان طبقهبندی سریع نمونهها بر اساس منشأ و یا وابستگی بیولوژیکی آنها تعریفشده است و در واقع شامل بررسی متابولیتهای داخل سلولی میباشد. سرانجام در سال ۲۰۰۵، کِل و همکارانش واژه «رد پای متابولیکی» را پیشنهاد کردند که به متابولیتهای خارج سلولی اشاره دارد. در سال ۲۰۱۵، اصطلاح پروفایل متابولوم در زمان واقعی توسط لینک و همکارانش پیشنهاد شد که به تزریق مستقیم باکتریها و سلولها در یک طیفسنج جرمی با وضوح بالا و نظارت بر صدها متابولیت اشاره دارد.
تعاریف و مراحل کار متابولومیکس
مطالعات مبتنی بر متابولومیکس را میتوان به دو دسته اصلی تقسیم کرد: روشهای متابولومیکس هدفمند و غیر هدفمند. روش متابولومیکس هدفمند به بررسی متابولیت های خاص و همچنین شناسایی بیومارکرهای احتمالی اطلاق میشود. روش متابولومیکس هدفمند بهعنوان آنالیز کمی (برای تعیین غلظت) و یا آنالیز نیمه کمی (تعیین شدت نسبی) از چند متابولیت یا سوبستراهای واکنشهای متابولیکی تعریفشده است که ممکن است در ارتباط با گروههای شیمیایی رایج یا مسیرهای متابولیک انتخابشده باشد. در حالیکه، روشهای متابولومیکس غیر هدفمند عمدتاً بر کشف بیومارکرهای جدید متابولیت یا تغییرات جدید در متابولیسم که ناشی از تنشهای بیولوژیکی است، تمرکز دارند.
تشریح کلیه متابولیت های یک سامانه زیستی، همانطور که قبلاً ذکر شد متعلق به متابولومیکس هدفمند است. روش متابولومیکس غیرهدفمند در درجه اول بر اساس آنالیز کیفی و یا نیمه کمی بیشترین تعداد ممکن از متابولیت ها از گروههای شیمیایی و بیولوژیکی متنوع موجود در یک نمونه بیولوژیکی است. هر دو مفهوم اثر انگشت و ردپای متابولیکی مربوط به این تعریف است.

مسئله بیولوژیکی و طراحی تجربی
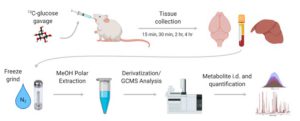
گام اولیه در مطالعات متابولومیکس مبتنی بر یک سؤال روشن و صریح از مشکل بیولوژیکی است که باید مورد توجه قرار گیرد. این مرحله از اهمیت حیاتی برخوردار است؛ زیرا طراحی آزمایش به آن وابسته خواهد بود. با توجه به مسئله بیولوژیکی، نوع و روش متابولومیکس (هدفمند یا غیر هدفمند)، نوع نمونه (مایعات بیولوژیکی، بافتها، سلولها و یا ارگانیسم سالم)، سایز نمونه (تعداد نمونههایی که باید ارزیابی شوند)، شرایط آزمایشگاهی نگهداری و ارسال نمونهها، دفعات جمعآوری نمونه، متوقف کردن متابولیسم برای قطع فعالیت آنزیمی (اضافه کردن حلالهای آلی یا خشککردن سریع نمونه از طریق افزودن نیتروژن مایع)، شرایط ذخیرهسازی نمونهها، برنامههای تحلیلی که مورد استفاده قرار میگیرند و همچنین استراتژیهای آمادهسازی نمونه باید در این مرحله تعریف شوند؛ زیرا ارتباط آنها با یکدیگر مهم است. این نکته تأکید میشود که مطالعات متابولومیکس همواره در ذات خود مقایسه را به همراه دارند؛ بنابراین یک گروه از نمونههای شاهد (بسته به مسئله تعریفشده، گروههای شاهد مختلف) و نمونههای آزمایش معمولاً در طراحی آزمایش تعریف میشوند.

آمادهسازی نمونه
هنگامیکه موضوع تحقیق تعریف میشود و شرایط آزمایشگاهی برای جمعآوری و ذخیرهسازی نمونه تعیین میشود، گام بعدی آمادهسازی نمونه است. آمادهسازی نمونه بهطور مستقیم با نوع نمونه، روش متابولومیکس و روش آنالیز انتخابشده ارتباط دارد. برای متابولومیکس هدفمند، روش استخراج معمولاً برای متابولیتهای خاص مورد بررسی قرار میگیرد و ممکن است مراحلی مانند پاکسازی برای حذف تداخلات ماتریکس نمونه و یا استراتژیهای پیشتغلیظ از قبیل استخراج مایع-مایع و فاز جامد را برای افزایش غلظت ترکیب شامل شود. برای متابولومیکس غیر هدفمند مایعات زیستی، آمادهسازی نمونه معمولاً حداقل زمان ممکن را به خود اختصاص میدهد. رسوب پروتئین گاهی بهعنوان یک معیار برای حفظ یکپارچگی ستون در آزمایشهای کروماتوگرافی مایع یا جلوگیری از مسدود شدن موئین در آزمایشهای الکتروفورز موئینه در نظر گرفته میشود. بهطورکلی در این مرحله، اغلب فیلتراسیون ساده و چند بار رقیق کردن انجام میشود. آمادهسازی بافت و یا سلول نیازمند روشهای استخراج دقیقتر است که معمولاً با استخراج فاز جامد با حلالهای خالص یا مخلوط حلالها انجام میشود و به دنبال آن سانتریفیوژ و رقیقسازی انجام میشود. آنالیز کروماتوگرافی گازی مایعات بیولوژیکی و عصارههای سلولی یا بافتی نیاز به مراحل مشتقسازی برای تبدیل ترکیبات غیر فرار به فرار دارد، زیرا در این روش فقط ترکیباتی قابلبررسی هستند که در دمای زیر 300 درجه سلسیوس قابلیت تبخیر شدن داشته باشند. لذا اگر ترکیبات سنگین و با دمای تبخیر بالاتر از 300 مورد بررسی هستند، لازم است حتماً مشتقسازی شوند. این مراحل زمانبر هستند و امکان اشتباه در آنها وجود دارد و منجر به محدود شدن تعداد کل نمونهها در یک آزمایش متابولومیکس میشوند. آزمایشهای NMR هم معمولاً نیاز به رقیق شدن نمونه در حلالهای دوتره مناسب دارند.
روشهای متابولومیکس
در بین روشهای آنالیز در متابولومیکس، تکنیکهای طیفسنجی جرمی و رزونانس مغناطیسی هسته به دلیل توانایی آنالیز تعداد زیادی از متابولیتها، رایجترین روشهای مورد استفاده هستند. علاوه بر این، هر دو روش دارای مشخصات منحصربهفردی هستند؛ بهطور مثال NMR تجدید پذیر و کمی است، در حالیکه MS بهطور ذاتی بسیار حساس است و در نتیجه تکنیک بسیار مهمی برای اندازهگیری متابولیتهای موجود در غلظتهای بسیار پایین در نمونههای بیولوژیکی پیچیده است. از طرفی دیگر در تکنیک NMR معمولاً از کروماتوگرافی استفاده نمیشود، اما روشهای MS اغلب با روشهای جداسازی مانند کروماتوگرافی گازی، کروماتوگرافی مایع با عملکرد بالا یا کروماتوگرافی مایع با کارایی فوقالعاده بالا و الکتروفورز موئینه (CE) در تحقیقات متابولومیکس متعدد ترکیب میشوند.
همچنین در طیفسنجی NMR، نمونهها میتوانند بهصورت مستقیم با حداقل دستکاری آنالیز شوند و بسیاری از متابولیتهای کوچک بهطور همزمان اندازهگیری شوند. همچنین مطالعات اخیر متابولومیکس نشان میدهد که با دستگاه NMR، در حدود ۴۹ متابولیت سرم انسان با غلظت بالای ۱۰ میکرو مول بر لیتر قابل شناسایی هستند درحالیکه تکنیکهای MS میتوانند بیش از ۹۰ متابولیت را با غلظتهای کمتر از ۱۰ میکرو مول شناسایی کنند.
طیفسنجی جرمی
استفاده از تکنیکهای مبتنی بر اسپکترومتری جرمی در متابولومیکس در طول دهه گذشته بهطور مداوم رو به افزایش بوده است. یکی از عمده مزایای MS این است که آنالیز کمی با حساسیت بالا و انتخابی را ارائه میدهد؛ در نتیجه استفاده مقادیر نسبتاً کمی از نمونه را ممکن میسازد. تکنیکهای جداسازی کروماتوگرافی (LC,GC,CE) که بهطورمعمول با آنالیز MS همراه میشوند، پیچیدگی طیفهای جرمی را کاهش میدهند. ترکیب این تکنیکها با یکدیگر، بهنوبه خود فرصتهای بهتری برای شناسایی ترکیبات فراهم میکند که میتوان نتایج بهتری با استفاده از پایگاه دادهها و مجموعههای متابولیتها به دست آورد. حساسیت بالای آشکارسازهای MS سبب میشود که این تکنیک بهعنوان یک روش آنالیز بسیار مناسب برای بررسی اختلالات پاتوفیزیولوژیکی پیچیده در نمونههای بیولوژیکی استفاده شود.
کروماتوگرافی مایع ـ طیفسنجی جرمی
این روش طیفسنجی به علت داشتن ویژگیهایی مانند پوشش طیف وسیعی از متابولیتها و آمادهسازی نسبتاً ساده نمونهها، بهعنوان یکی از محبوبترین فنآوریها برای تشخیص متابولیت در طی سالیان اخیر شناخته شده است. حساسیت بالای MS منجر به توانایی تشخیص صدها تا بیش از هزار مولکول کوچک در یک آزمایش واحد میشود. ویژگیهای منحصربهفرد LC-MS امکان تشخیص مستقیم متابولیت ها از مخلوطهای بیولوژیکی بدون نیاز به اصلاح شیمیایی را فراهم میکند. پروتکلهای مرحلهبهمرحله برای آنالیز LC–MS از انواع مختلف مخلوطهای بیولوژیکی از جمله سرم، ادرار و همچنین برای آنالیز بافت حیوان و انسان در دسترس هستند.
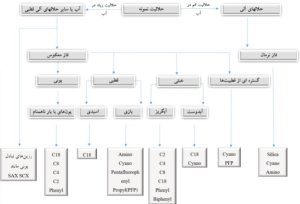
انواع متفاوتی از ستونهای LC از قبیل کروماتوگرافی مایع فاز معکوس (RPLC)، کروماتوگرافی برهمکنش آبدوستی (HILIC) و بهندرت کروماتوگرافی مایع جفت یون (IPLC) برای جداسازی متابولیتها قبل از آنالیز جرمی، بسته به ماهیت متابولیتهای مورد بررسی استفاده میشود، و منجر به پوشش طیف گستردهای از متابولیتها و قطبیتها میشود. تقریباً تمام پُرکنندههای فاز پیوندی از جنس سیلیس یا ترکیباتی بر پایه سیلیس تهیه میشوند. هرگاه فاز ساکن پیوند دادهشده روی پُرکننده بهشدت قطبی (مانند آب یا تری اتیلن گلایکول) باشد، اصطلاحاً به آن فاز نرمال و اگر غیرقطبی باشد به آن فاز معکوس میگویند. در کروماتوگرافی فاز نرمال، فاز متحرک یک حلال نسبتاً غیرقطبی مانند هگزان، کلروفرم و دی اتیل اتر است که در آن ابتدا غیرقطبیترین جزء شسته میشود، زیرا از همه بیشتر در فاز متحرک حل میشود، همچنین با افزایش قطبیت فاز متحرک زمان شویش کم میشود. درحالیکه در کروماتوگرافی فاز معکوس، فاز متحرک قطبی است: مانند آب، متانول یا استونیتریل. در این روش، ابتدا قطبیترین جزء ظاهر میشود و افزایش قطبیت فاز متحرک زمان شویش را افزایش میدهد.
فازمعکوس (RPLC) در درجه اول برای جدا کردن طیف گستردهای از متابولیتها استفاده میشود. گرچه هر دو متابولیتهای قطبی و غیرقطبی را میتوان با RPLC از هم جدا کرد، اما متابولیتهایی با قطبیت بسیار بالا به خوبی در فازهای ثابت رایج RPLC حفظ و جداسازی نمیشوند. در عوض، کروماتوگرافی تعامل هیدروفیلی HILIC به همراه آنالیز MS معمولاً برای تجزیه و تحلیل متابولیتهای بسیار قطبی مورد استفاده قرار میگیرد. پس از جداسازی با کروماتوگرافی، متابولیتها در منبع یون MS یونیزه میشوند. منبع یونیزاسیونی که معمولاً برای پروفایل متابولیتها مبتنی بر LCMS مورد استفاده قرار میگیرد، یونیزاسیون الکترواسپری است که در حالت مثبت یا منفی برای یونیزاسیون طیف وسیعی از متابولیتها عمل میکند و بهعنوان منبع یونیزاسیون نرم شناخته میشود.
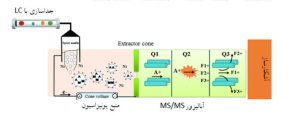
طیفسنجی جرمی متوالی MS/MS، که در واقع توسعه آنالیز جرمی میباشد امکان تکهتکه شدن آگاهانه یونهای انتخابشده را فراهم میسازد. در طیفسنج جرمی اول (MS1) معمولاً فقط یون مولکولها تولید میشوند و سپس این یونهای پیشرو وارد محفظه برهمکنش میشوند. در این محفظه چندین مکانیسم و روش میتواند برای قطعهقطعه شدن به کار رود. پس از این مرحله، یونهای قطعهقطعه شده به آنالیزور جرمی دوم (MS2) منتقل و در نهایت شناسایی میشوند.
کروماتوگرافی گازی ـ طیفسنجی جرمی
تکنیک کروماتوگرافی گازی–طیفسنجی جرمی به علت عوامل متعددی از جمله قابلیت اطمینان به آن و هزینههای نسبتاً پایین تعمیر و نگهداری دستگاه، بهطور گستردهای در مطالعات متابولومیکس استفاده میشود. بهطور عمده این دستگاه برای شناسایی و تعیین مقدار نمونههایی استفاده میشود که فرار هستند و همچنین در برابر حرارت پایدار هستند. ترکیباتی که فرار نباشند، اغلب بهواسطه ترکیب با برخی واکنشگرها و یا حلالهای خاص، مشتقسازی شده و تبدیل به گونهی فرار میشوند.
درنتیجه، تکنیک GCMS میتواند برای آنالیز طیف وسیعی از متابولیت ها شامل لیپیدها، پپتیدها، الکلها، اسیدهای آلی، اسیدآمینه، کتونها، آلدهیدها، استرها، سولفیدها، قندها، قندهای فسفاته، قندهای الکلی، آلکالوئیدها، آمینها و آمیدها مورد استفاده قرار گیرد. آنالیز GCMS با توجه به استفاده از متحرک گازی و طبیعت انرژی بالای منبع یونیزاسیون آن (بهطور معمول ۷۰ الکترونولت)، بهطورکلی از اثرات تداخلی سرکوب یون بر شدت سیگنال متابولیت جلوگیری میکند، که این موضوع یکی از چالشهای عمده در آنالیز LCMS میباشد. تشخیص ۱۵۰ تا ۲۰۰ متابولیت شناساییشده همراه با چند صد متابولیت ناشناخته و ویژگیهای طیفی آنها بهطورمعمول با استفاده از آنالیز GCMS نمونههای استخراجشده از مایعات بیولوژیکی و یا بافت امکانپذیر است. متابولیتهایی که در گروههای عاملی خود دارای هیدروژنهای فعال هستند؛ مانند COOH، NH، SH و OH، میتوانند با استفاده از واکنشهای آلکیلاسیون، آسیلاسیون و سیلیلاسیون مشتقسازی شوند. سیلیلاسیون مرسومترین روش استفاده در مشتقسازی است که در آن یک اتم هیدروژن فعال با یک گروه سیلیل جایگزین میشود. واکنشگرهای سیلیلاسیون متفاوتی وجود دارد که هرکدام از آنها دارای مزایا و معایب خاص خود هستند. این روش مشتق سازی بهطورمعمول شامل دو مرحله است که مرحله اول واکنش متوکسی دار شدن است که از انولاسیون گروههای کتونی جلوگیری میکند و مرحله بعد واکنش سیلیلاسیون است که طیف وسیعی از متابولیت ها را پوشش میدهد. منبع یونی که عمدتاً در تکنیک GCMS استفاده میشود، یونیزاسیون برخورد الکترون است. در طراحی برخی از دستگاهها بهجای یونیزاسیون برخورد الکترون (EI) یا به همراه آن یونیزاسیون شیمیایی را به کار میبرند. بهطورکلی (CI) بهعنوان یک منبع یونیزاسیون نرمتر در نظر گرفته میشود و معمولاً پیک M+ را نشان میدهند که این جرم مربوط به مولکول اولیهای است که یک الکترون ازدستداده است، درحالیکه در یونیزاسیون برخورد الکترون (EI) فقط قطعات مولکولی دیده میشود. در بیشتر تحقیقاتی که مبتنی بر متابولومیکس است، از دستگاههای GCMS که به آنالیزورهای جرمی چهارقطبی و زمان پرواز مجهز شدهاند، استفاده میشود. آنالیزورهای زمان پرواز (TOF) بهوضوح دقیقتر جرم مولکولی و تشخیص سریع متابولیتها، بهخصوص در زمان برخورد با پیکهای باریک و ناشناخته در کروماتوگرام کمک میکنند. تکنیکهای دوبعدی LC-LCMS و GC-GCMS، جداسازی متابولیتها را با استفاده از روشهای کروماتوگرافی متوالی بهبود میبخشند. در مقایسه با GCMS، کروماتوگرافی دوبعدی GC-GCMS، دارای وضوح و حساسیت بالاتری است. در نتیجه تعداد متابولیتهای قابل تشخیص بهشدت افزایش مییابد و برای مطالعات متابولومیکس بسیار سودمند است.
دیگر تکنیکهای مبتنی بر MS
طیفسنجی جرمی الکتروفورز موئینه از دیگر تکنیکهای مورد استفاده در مطالعات متابولومیکس است که محدود به آنالیز مولکولهای باردار بوده، و اغلب دارای حساسیت پایینتری در مقایسه با دستگاههای GCMS و یا LCMS میباشد. اگر از لیزر بهعنوان پرتو پرانرژی استفاده شود، این روش یونیزاسیون را واجذب لیزری به کمک زمینه مینامند که همراه با طیفسنج جرمی (MALDI-MS) و تصویربرداری طیفسنجی جرمی (MALDI-MSI) بهطور فزایندهای برای مطالعات متابولومیکس، بهخصوص آنهایی که بافت سلول و بخشهایی از آنها را ارزیابی میکنند، مورد استفاده قرارگرفته است.
پردازش دادهها
دادههای خام بهدستآمده در متابولومیکس غیر هدفمند، با توجه به نوع روش آزمایشگاهی که جهت ارزیابی مورداستفاده قرارگرفته است، به مرحله پیشپردازش منتقل میشوند. در تکنیک NMR، پردازش دادهها شامل مرحلهبندی، اصلاح پایه، همترازی و نرمالسازی است. نرمافزارها و الگوریتمهایی مانند PERCH، Chenomx NMR suite، MestReNova،MetaboLab، Autofit، TopSpin و MATLAB بهطورمعمول در پردازش دادههای NMR استفاده میشود.
مرحله اول برای پردازش دادهها در اسپکترومتری جرمی، پردازش دادههای خام MS بهدستآمده از طریق نرمافزار دستگاه است که معمولاً دادههای خام خروجی، قابلیت استفاده در متابولومیکس را ندارند و باید پردازش شوند. در مرحله بعد از پیشپردازش، دادههای پردازششده شناساییشده و هرکدام بهعنوان یک متابولیت نشانهگذاری میشوند. در مرحله آخر پردازش، روشهای مبتنی بر شبکهسازی جهت ارتباط متابولیتها و مسیرهای بیولوژیک با استفاده از خصوصیات متابولیتها و آنالیزهای آماری، به کار گرفته می شوند.
پردازش داده های MS
دادههای MS تولیدشده توسط نرمافزار دستگاه معمولاً توسط محققان قابلیت استفاده مستقیم ندارد و نیازمند یک کتابخانه نرمافزاری هستند که معمولاً از طریق (DLL) به کاربران عرضه میشوند تا در صورت نیاز دادهها را پردازش و تفسیر کنند. از آنجاییکه همه DLLها، رابط برنامهنویسی اپلیکیشن (API) یکسانی ندارند، برای کاربران دانشگاهی بسیار دشوار است تا نرمافزاری طراحی کنند که همهی API ها را بهعنوان ورودی بپذیرد. به همین دلیل، ارائهدهندگان نرمافزارها قابلیت دسترسی به دادههای با فرمت باز را به کاربران دادهاند. این فرمتهای باز netCDF، mzData، mzXML و mzML هستند که برای تمامی سیستمعاملهای رایج مثل ویندوز، مک و لینوکس قابل خواندن هستند. فرمت netCDF محدود به دادههای GC-MS و LC-MS ساده است و نمیتواند ترکیبی از دادههای MS و MS/MS باشد. برای رهایی از این محدودیت، فرمتهای mzXML و mzML معرفی شدند که نهتنها محدودیتهای فرمت قبلی را ندارند، بلکه علاوه بر دادههای طیفی، کروماتوگرامها (بهعنوانمثال برای SRM) را هم در برمیگیرند. برای ایجاد فایلهایی با فرمت mzML دو روش کلی وجود دارد: در حالت اول در برخی نرمافزارهای ارائهشده برای دستگاهها، امکان ذخیرهسازی فایل با فرمت mzML را دارند که هنگام ذخیرهسازی باید گزینه ذخیره به فرمت موردنظر را انتخاب کرد. در روش دوم میتوان از نرمافزارهای تبدیل کننده استفاده کرد. سایت گروه Proteowizard با ارائه نرمافزاری به نام msconvert کمک بزرگی به تبدیل فایلهای خام LC-MS و GC-MS به فرمت mzML کرده است.

در دادههای خام MS، تعداد بسیار زیادی طیف وجود دارد که همه آنها در زمان run کردن نمونه از آن جمعآوریشدهاند و هرکدام از آنها حاوی تعداد بسیار زیادی m/z هستند. برای کاهش پیچیدگی این دادهها، اصطلاحاً به هر داده خامی که از یک یون مجزا نشأت میگیرد، ویژگی یا feature خاصی (بهاختصار در اینجا ft) اطلاق میشود. هرکدام از این ftها دارای یک m/z، یک زمان بازداری و یک شدت میباشند. برای تشخیص ftها از یکدیگر و از نویزها، از الگوریتمهای ریاضی کمک گرفته میشود. یکی از هوشمندانهترین روشهای تشخیص ftها استفاده از الگوریتمهای غربال است که در آن خصوصیات کلی ft موردنظر به الگوریتم داده شده و الگوریتم بر اساس آن، ft موردنظر را شناسایی کرده و آنها را از نویزها تمییز میدهد که مثال این الگوریتم، الگوریتم کلاه مکزیکی (Mexican hat) است. این الگوریتم، یک شبکهی خودسازمانده که با SOM یا برخی مواقع بهصورت SOFM نشان داده میشود، واحدهای پردازشگر را در گره های یک شبکهی یکبعدی، دوبعدی یا بیشتر قرار داده میشوند. واحدها در یک فرآیند یادگیری رقابتی نسبت به الگوهای ورودی منظم میشوند. محل واحدهای تنظیمشده در شبکه بهگونهای نظم مییابد که برای ویژگیهای ورودی، یک دستگاه مختصات معنیدار روی شبکه ایجاد شود. لذا یک نقشهی خودسازمانده، یک نقشهی توپوگرافی از الگوهای ورودی را تشکیل میدهد که در آن، محل قرار گرفتن واحدها، متناظر با ویژگیهای ذاتی الگوهای ورودی است. آخرین مرحله تشخیص ftها محاسبه m/z بر اساس میانگین شدت پیکها، زمان بازداری بر اساس محل قرارگیری پُر شدتترین سیگنال و شدت هم بر اساس سطح زیر منحنی ft محاسبه میشود. بهطورکلی، قدرت الگوریتمهای غربال به توانایی تشخیص و تمییز ftها در برابر نویزها بستگی دارد.
هنگام آنالیز و بررسی یک ft در تعداد زیادی از نمونهها، به علت طبیعت و ماهیت تکنیکهای Hyphenated، تفاوت ناچیزی بین RT و m/z یک ft در نمونههای مختلف وجود دارد. به همین دلیل در اینجا گروهبندی ft ها بسیار مهم و حیاتی است که درنهایت به تشکیل یک ماتریکس مربعی میانجامد. این ماتریکسها در فرمتهای مختلف قابل ذخیرهسازی هستند: فرمت mzTab-M یا mwTab برای بارگذاری در پلتفرم متابولومیکس NIH یا فرمت MAF برای بارگذاری در Metabolights.
برای ارتباط بین ftهای مرتبط باهم در نمونههای مختلف روشهای مختلفی وجود دارد. بسیاری از این روشها مبتنی بر خوشهبندی بر اساس m/z و زمان بازداری است. بهعنوانمثال در پلتفرم OpenMS این قابلیت تحت نام FtLinker وجود دارد که از طریق یک الگوریتم Unlabelled-qt عمل میکند. پلتفرم XCMS هم روش متفاوت دیگری بر اساس کروماتوگرام استخراجشده یون دارد.

بدیهی است دستگاههای مختلف قدرت شناسایی برابری ندارند و لزوماً یک ft خاص در یک دستگاه با ft بهدستآمده از روش دیگر، زمان بازداری و بار به جرم یکسانی ندارد. در سال ۲۰۱۴ یک سیستم نمرهدهی معرفی شد که نشاندهنده قدرت آنالیز پلتفرمهای مختلف است. اگرچه این سیستم سهولت مقایسه را فراهم میسازد اما همچنان وابستگی زیادی به نوع دستگاه و نمونه دارد؛ بنابراین همواره ذکر کردن روش دستگاهی در متابولومیکس از اهمیت ویژهای برخوردار است.
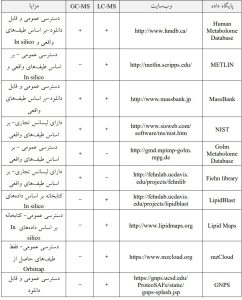
استفاده از کتابخانه ها و پایگاههای داده برای تشخیص ترکیب موردنظر هم در این روش جایگاه ویژهای دارد. اگرچه این پایگاهها پیشرفت زیادی داشتهاند اما هنوز کامل نیستند و علت آنهم در دسترس نبودن بسیاری از ترکیبات طبیعیِ بهصورت استاندارد خالصشده است. تعدادی از پایگاههای داده معتبر در جدول زیر آمده است.
پردازش داده های NMR
اولین مرحله در آنالیز دادههای حاصل از NMR اصطلاحاً مرحله پیشپردازش نام دارد که در این مرحله، FIDهای جمعآوریشده از نمونه، از فرمت زمانی به فرمت فرکانسی تبدیل میشوند که این امر باعث ایجاد یک طیف قابل تفسیر NMR میشود. در مرحله بعد، طیفهای بهدستآمده تبدیل به ماتریسهایی از داده میشوند که حاوی اطلاعاتی اعم از شدت سیگنال مربوط به هر متابولیت شناساییشده و نواحی طیفی هستند. در مرحله آخر هم این ماتریکسها بهعنوان ورودی به نرمافزارهای آنالیز آماری وارد میشوند. این نکته قابلتأمل است که مراحل پردازش داده در NMR بسیار به محیط و ماهیت نمونه وابسته است و بنابراین هر روشی قابلیت استفاده برای هر نمونهای را ندارد و نمیتوان یک روش عمومی برای همه نمونهها پیشنهاد داد. دیاگرام کامل پردازش دادههای NMR در زیر توضیح دادهشده است.

داده های FID از طریق دستگاه و نرمافزار مختص آن ایجاد می شوند. سپس مراحل پیشپردازش متفاوتی اعمال می شوند که معمولاً در امتداد یکدیگر قرار دارند و دادهی NMR را از دامنه زمانی به دامنه فرکانسی تبدیل می کنند. سپس سه استراتژی متفاوت بر اساس طراحیهای قبلی قابل اتخاذ است. هرکدام از این روشها به خروجی داده متفاوتی ختم می شود.
برای تکنیکهای مبتنی بر طیفسنجی جرمی، پردازش دادهها شامل تفکیک طیفی، ایجاد مجموعه دادهها، گروهبندی، همترازی، پر کردن شکافهای دادهها، نرمالسازی و تبدیل دادهها میباشد. تعدادی از نرمافزارهای اختصاصی و رایگان مانند XCMS،Mass profiler professional،MZ mine، MetAlign،MassLynx، AMDIS (متعلق به شرکت Waters) و غیره برای پردازش دادههای جرمی در دسترس است.
سنجش کمی یا نیمه کمی آنالیت در متابولومیکس هدفمند، بخشی از پردازش دادهها به شمار میرود و معمولاً از طیفسنجی جرمی بهجای NMR استفاده میشود. در آنالیز هدفمند متابولومیکس، استفاده از استانداردهای داخلی برای بهبود دقت و مقابله با اثرات ماتریکس توصیه میشود، بهخصوص استانداردهای داخلی نشاندار ایزوتوپی. نظارت بر واکنشهای انتخابشده، یکی از ابزارهای متفاوت و کاربردی در آنالیز متابولومیکس هدفمند است و همراه با طیفسنجهای جرمی چهارقطبی سهگانه استفاده میشود.
یکی از روشهای جایگزین برای متابولومیکس جامع هدفمند که اخیراً مورد توجه قرارگرفته است، استفاده از کیتهای تجاری موجود در بازار است. آنالیز کمی طیفسنجی جرمی با کارایی بالا از صدها متابولیت از چند طبقه شیمیایی (آسیل کارنیتینها، اسیدهای آمینه، هگزوزها، فسفو اسپینگو لیپیدها، آمینهای بیوژنیک و …) انجام شده و سپس ارزیابی آماری نتایج منجر به انتخاب متابولیتهای با فراوانی بیشتر میشود. اگرچه معمولاً پس از آنالیزهای آماری بسیاری از ترکیبات به علت مقدار کم نادیده گرفته میشوند، اما در نهایت متابولیتهای با فراوانی بیشتر اندازهگیری میشوند. این روش، مخالف با روش سنتی و معمول است؛ بهطوریکه در روشهای رایج متابولومیکس غیر هدفمند، متابولیتهای بالقوۀ متمایز بهطور کیفی نشان داده میشود که معمولاً تعداد کمی از این ترکیبات، بعدها توسط متابولومیکس هدفمند مورد سنجش و ارزیابی آماری قرار میگیرند. یکی از معایب متابولومیکس جامع هدفمند مربوط به این واقعیت است که تلاشهای تحلیلی زیادی روی سنجش کمی صدها متابولیت انجام میشود که ممکن است اطلاعات قابلتوجهی نداشته باشد و جستجوی متابولیتهای متمایز بر روی تعداد محدودی از گروههای شیمیایی توسط کیتهای تجاری انجام میشود و گامی برای کشف متابولیتهای جدید باقی نمیماند.
آنالیز آماری
دادههای متابولومیکس بسیار پیچیده هستند؛ بنابراین، برای نشان دادن متابولیتهای متمایز بین نمونههای کنترل و تست نیاز به ابزارهای ارزیابی میباشد. آنالیزهای چند متغیره، شامل آنالیز مؤلفه اصلی، آنالیز متمایز حداقل مربعات جزئی و تصویرهای همسنجیهای متعامد از آنالیز تفکیکی ساختارهای نهفته (OPLS-DA) اغلب برای بررسی و طبقهبندی نمونهها استفاده میشود. آنالیز تک متغیره بر اساس آزمون تی استیودنت، آزمون یو من-ویتنی و غیره نیز برای تائید نتایج چند متغیره (و البته بر اساس تعداد نمونه ها) استفاده میشود. مدلهای ریاضی باید اعتبارسنجی شوند که با روشهای اعتبارسنجی متقابل و آزمونهای جایگزین انجام میشود.
شناسایی متابولیتها
اگرچه در متابولومیکس هدفمند، متابولیت یا متابولیتهای مورد نظر از قبل تعریف و تعیینشده است، در مطالعات متابولومیکس غیر هدفمند شناسایی متابولیتها ضروری است. برای این منظور، پایگاه دادهها و کتابخانههای رایگان مانند HMDB ، KEGG، PubChem، Metlin، MassBank، LIPID MAPS، ChEBI، MMD، MetaboID، BioMagResBank و Chenomx NMR suite، در دسترس هستند.
همچنین MASSTRIX یک ابزار جستجو است که از برخی از پایگاههای داده ذکرشده در بالا استفاده میکند. هنگامیکه هویت یک متابولیت احتمالی مشخص شد، جهت تعیین دقیقتر آن میتوان از تکنیکهای تزریق همزمان استاندارد داخلی و نمونه و سپس مقایسه الگوهای تکهتکه شدن طیفهای جرم و یا NMR دوبعدی بین نمونه و استاندارد استفاده کرد. معمولاً از ترکیبی بهعنوان استاندارد داخلی استفاده می شود که نزدیکترین ساختار را به ترکیب مورد نظر دارد. اضافه کردن استاندارد داخلی بهمنظور خنثیسازی اثرات یونیزاسیون و پارامترهای دخیل در فرایند یونسازی است.
ارتباط مسیرهای متابولیک
تفسیر بیولوژیک، گامی مهم در مطالعات متابولومیکس هدفمند و غیر هدفمند به شمار میرود. هنگامیکه متابولیتهای احتمالی شناسایی شدند و هویت آنها به تأیید رسید، سپس مسیرهای متابولیکی مربوطه مورد بررسی قرار میگیرند. چندین پایگاه داده برای این موضوع در دسترس هستند: KEGG، MetaCyc، MetaboLights، Reactome و غیره. هنگامیکه متابولیتهای متفاوت با مسیرهای متابولیک به یکدیگر مرتبط میشوند، پاسخگوی سؤالهای اصلی بیولوژیک هستند که در واقع متابولومیکس را هدایت میکنند.
اعتبارسنجی بیولوژیکی
اگرچه پس از اتمام مطالعه متابولومیکس، اعتبارسنجی بیولوژیکی معمولاً دنبال نمیشود، اما بسیاری از نویسندگان بر این باورند که مطالعات تنها زمانی معنای گسترده تری خواهد داشت که نتایج اعتبارسنجی شوند. معمولاً اعتبارسنجی خارجی توصیه میشود، که در آن یک مجموعه کاملاً جدید از نمونهها جمعآوری و پردازش میشوند. متابولیتهای متمایز اولیه که در مطالعات متابولومیکس غیر هدفمند یافت میشوند، میتوانند بهصورت کمی در مجموعه نمونههای مشابه مورد بررسی قرار گیرند. گانتی و همکارانش تحقیقات متابولومیکس غیر هدفمند را با استفاده از نمونههای ادرار بیماران مبتلابه سرطان کلیه انجام دادند و کنترل آنها سطح بالایی از آسیل کارنیتین های مرتبط با وضعیت سرطان و درجه سرطان کلیه را نشان داد. این مطالعه سپس با آزمایشهای برونتنی تأیید شد و آزمایشها نشان داد که آسیل کارنیتینها بر بقای سلول تأثیر گذاشته و منجر به التهاب میشوند. بهاینترتیب، اعتبارسنجی بیولوژیک برای تأیید نتایج اولیه بهدستآمده از مطالعه متابولومیکس اصلی به کار میرود و همچنین تفسیر بیولوژیک نتایج را تثبیت میکند.
اهمیت متابولومیکس در مطالعات بالینی
از ابتدای متابولومیکس تا به امروز، بیشترین کاربردها بر روی متابولومیکس گیاه متمرکز بوده است. با این وجود، اخیراً متابولومیکس بالینی به دلیل توانایی ارائه فنوتیپ مولکولی مایعات زیستی، سلولها یا بافتها مورد توجه قرارگرفته است. در این راستا، متابولومیکس بالینی بهطور فزایندهای برای تشخیص بیماریها، درک مکانیسم بیماری، شناسایی اهداف داروهای جدید، سفارشی کردن درمانهای دارویی و نظارت بر نتایج درمانی مورداستفاده قرار میگیرد. همانطور که متابولیتها بیانگر نقطه پایان بیان ژن و فعالیت سلولی هستند، متابولومیکس میتواند یک روش جامع برای درک فنوتیپ یک ارگانیسم را ارائه دهد و نقش اساسی در زیستشناسی سامانهها ایفا نماید. خصوصیات فنوتیپهای متابولیکی مبتنی بر بیماریها، کشف اهداف درمانی جدید و نشان دادن نشانگرهای زیستی بالقوه است که برای تشخیص بیماری یا نظارت بر فعالیتهای درمانی استفاده میشوند.